Глава 16. Хирургическое лечение эректильной импотенции (Михайличенко В.В.)
До недавнего времени считалось, что 70-90% половых расстройств имеет психоневрогенное, функциональное происхождение. В последние 5 лет взгляды на этиологию и патогенез импотенции изменились. Большинство авторов признают, что 50-80% половых расстройств у мужчин возникает вследствие органических заболеваний [Каrаkan J., Moore V., 1982; Porst H. et al., 1983; Nessi R. et al., 1984; Virag L. et al., 1985; Stief Ch. et al., 1986]. Наиболее частым проявлением импотенции является нарушение эрекции, расстройство которой наблюдается у 80-85% больных импотенцией.
Половые расстройства у мужчин, обусловленные отсутствием или резким ослаблением эрекции, приобретают социальное значение, приводят к распаду семьи, безотцовщине, психическим срывам, нарушению трудоспособности больных.
Распространенность сексуальных нарушений составляет 20-25% среди мужчин потентного возраста [Зильберман М. Н., 1986] и имеет тенденцию к нарастанию. Эректильная дисфункция наблюдается у 5% мужчин до 40 лет и у 20% - после 60 лет. Огромное количество консервативных методов лечения оказываются мало или вовсе не эффективны у 40-50% больных. По данным М. И. Когана (1986), консервативная терапия эректильной импотенции соматогенной природы оказывается неэффективной в 70,4% наблюдений, улучшение эректильной функции достигается у 22,2% больных, а кратковременный и нестойкий результат - в 7,4% случаев. Низкая результативность консервативной терапии потребовала разработки действенных хирургических методов лечения эректильной импотенции. Столь же неутешительны результаты лечения психогенной импотенции. По данным М. Bloom (1983), рецидив психогенной импотенции наблюдается у 40-60% больных. М. Annexton (1984) отмечает рецидив после психотерапии на протяжении 5 лет у 70% леченых. В последние годы в оперативном лечении импотенции наметились 3 направления: 1) имплантация протезов в половой член для создания искусственной плотности, достаточной для осуществления полового сношения; 2) выполнение корригирующих операций на сосудах, направленных на усиление притока артериальной крови или устранение нарушений оттока ее от полового члена; 3) трансплантация яичка при эндокринной форме импотенции с целью восполнения дефицита андрогенов.
М. И. Коган (1987) выделяет 3 основные причины соматогенной эректильной импотенции: сосудистую, нейрогенную и эндокринную.
На долю сосудистой эректильной импотенции различного происхождения приходится около 25-70% [Бакрадзе А. К., Эвдошвили И. И., 1986; Горпинченко И. И., 1986; Virag R. et al., 1985]. Сосудистая импотенция является наиболее частым страданием у лиц старшей возрастной группы (свыше 40 лет). Эндокринные нарушения являются причиной эректильной импотенции в 5-7% случаев.
Внутрикавернозная медикаментозная терапия эректильной импотенции. Для диагностики и лечения сосудистой импотенции в последние годы большое распространение получило внутрикавернозное введение вазоактивных препаратов, способных увеличивать приток артериальной крови и уменьшать отток венозной крови. Предпочтение отдается папаверину и фентоламину.
В течение 10-15 мин после введения препаратов в кавернозные тела наступает эрекция, продолжительность которой сохраняется от 15 мин до 4 ч, благодаря чему большинство больных оказываются способными к половому сношению.
В шприц набирается смесь папаверина гидрохлорида (20-80 мг) и фентоламина (0,5-1,5 мг, общий объем от 1 до 2 мл) в зависимости от массы тела больного. Кавернозное тело прокалывают иглой для инъекций инсулина у основания полового .члена в постлатеральном направлении. Лекарство вводится медленно. Для возбуждения эрекции возможно введение лишь папаверина гидрохлорида в указанной выше дозе. Введение препаратов может сопровождаться быстро проходящей тахикардией, небольшим подъемом артериального давления, временной парестезией головки полового члена, появлением кровоизлияний, отека кожи, замедлением эякуляции. Имеются также сообщения о возникновении приапизма, вызванного внутрикавернозным введением указанных препаратов, для предупреждения которого лечение следует начинать с малых доз. Если эрекция держится более 6 ч, то показано внутрикавернозное введение α-адренергических препаратов. Рекомендуется вводить допамин из расчета 2-4 мкг/кг или 2 мг метараминола. Хороший эффект дает пункция кавернозных тел, удаление 200-300 мл крови с последующим промыванием изотоническим раствором натрия хлорида, содержащим 40 мг эфедрина. При неэффективности указанных мероприятий показаны корригирующие операции.
Из отдаленных осложнений при длительном применении внутрикавернозных инъекций возможны возникновение фиброза и девиации полового члена, нарушение функции печени.
При овладении техникой лечения больные с успехом могут самостоятельно производить внутрикавернозные инъекции вазоактивных препаратов, которые могут оказаться довольно эффективным вспомогательным способом лечения импотенции.
Операции на сосудах и пещеристых телах. При нарушении притока крови к половому члену патогенетически оправданным способом лечения является хирургическое вмешательство реваскуляризирующего характера. Этот вид вмешательства выполняется в ангиохирургии и заключается в замещении пораженного участка брюшного отдела аорты или ее бифуркации аллопластическим сосудистым трансплантатом или эндартерэктомии, проведении дезоблитерации внутренней чревной артерии при нарушении ее проходимости в результате атеросклеротического поражения (рис. 61, а). Часто эти виды оперативого вмешательства являются одним из компонентов реконструкции сосудов при операциях по поводу синдрома Лериша, тромбоза подвздошных артерий и аневризмы. Эти операции, восстанавливая прямой ток артериальной крови к сосудам полового члена, приводят к нормализации эрекции. При окклюзиях половой артерии и артерий полового члена (рис. 61, б) наибольшее признание получили 2 вида операции: артериокавернозное шунтирование и реваскуляризация половых артерий и артерий полового члена.
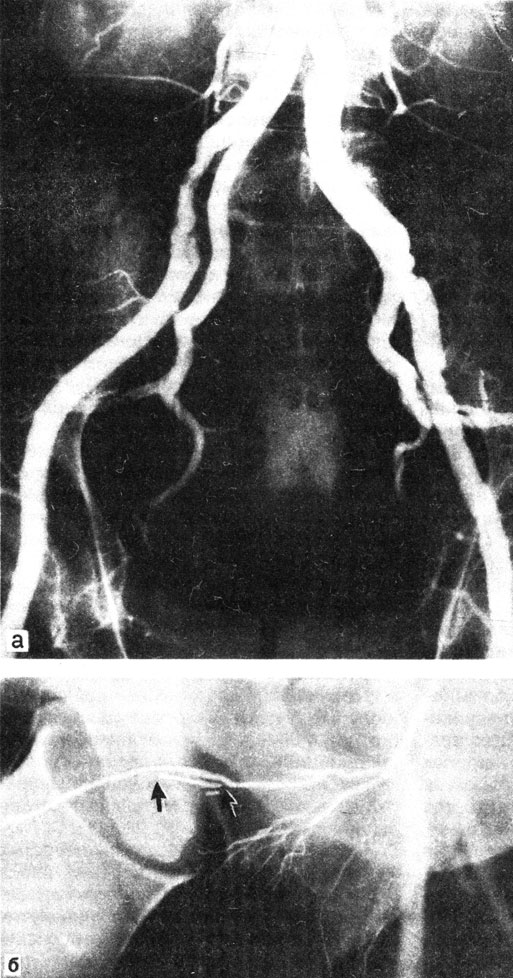
Рис. 61. Атеросклеротическое поражение подвоздошных артерий (а). Облитерация глубокой артерии полового члена (б)
При дефиците артериализации кавернозных тел полового члена наибольшее распространение получила операция артериокавернозного шунтирования с использованием внутренней чревной артерии (рис. 62). Эпигастрико-кавернозный анастомоз впервые описан V. Michal и соавт. (1973) .
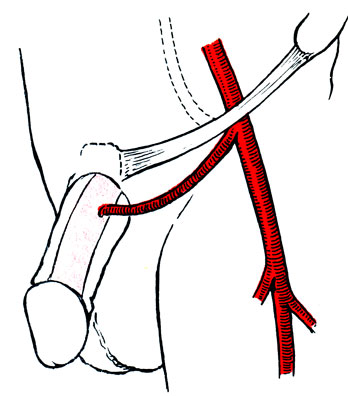
Рис. 62. Схема операции артериокавернозного шунтирования
Под общим наркозом разрезом длиной 15 см по наружному краю прямой мышцы живота от уровня наружного отверстия пахового канала вверх вскрывают влагалище прямой мышцы живота. В верхней части разреза по задней поверхности мышцы определяется нижняя надчревная артерия, которую следует в этом месте пересечь, перевязывая мелкие мышечные ветви, мобилизовать в проксимальном направлении вплоть до отхождения ее от наружной подвздошной артерии. Разрезом у корня полового члена обнажают поверхность кавернозных тел, подкожно проводят турникет, затягиванием которого прекращают приток артериальной крови в пещеристые тела. В белочной оболочке кавернозного тела дистальнее турникета вырезают отверстие диаметром 5-6 мм, к которому в проделанном в подкожной клетчатке туннеле подводят конец выделенной ранее надчревной артерии. Ее промывают раствором новокаина с гепарином, после чего производят гидравлическую дилатацию для расширения просвета сосуда после наложения проксимальнее сосудистого мягкого зажима. После этого накладывают анастомоз узловыми швами атравматической иглой 5-0. Для создания более широкого анастомоза при небольшом просвете артерии приходится прибегать к косому срезу или рассечению на протяжении 6 мм одной из стенок конца подчревной артерии. Операция проводится с использованием оптических систем. По данным Ф. В. Баллюзека (1988), после восстановления кровотока по шунту в минуту проходит около 30-40 мл крови, что дает до 30% от нормального суммарного артериального дефицита полового члена. Кровоток менее 25 мл/мин указывает на техническую ошибку в наложении анастомоза (стеноз, неполное вскрытие белочной оболочки, перегиб артерии).
P. Metz, С. Frimodt-Moller (1983) оценивают результаты эпигастрико-кавернозного анастомоза, проведенного у 9 больных, как неудовлетворительные, и считают, что необходим поиск новых методов реваскуляризации кавернозных тел. В связи с ограниченными возможностями эпигастрико-кавернозного анастомоза при значительном уменьшении общего артериального притока Ф. В. Баллюзек рекомендует применять другой тип реваскуляризации - создание шунта между наружной подвздошной артерией и кавернозными телами с помощью аутовены. В этом случае используется сегмент подкожной вены, взятой из голени над медиальной лодыжкой. После иссечения вены, длина которой должна быть не менее 15 см, ее промывают раствором новокаина с гепарином и проверяют целость гидравлической дилатацией. Через паховый доступ обнажают участок наружной подвздошной артерии в месте перехода в бедренный канал. Описанным выше способом обнажается белочная оболочка кавернозного тела с соответствующей стороны, в которой вырезается отверстие. После этого отрезок реверсированной вены с учетом расположения клапанов вшивают сначала в дефект белочной оболочки, затем в стенку подвздошной артерии после предварительного наложения сосудистых зажимов: так как пропускная способность вены достаточно велика (до 100 мл/мин и более), то после снятия зажимов может возникать состояние приапизма. В таком случае следует под контролем флоуметрии уменьшить кровоток с помощью лигатуры до устранения приапизма. При этом кровоток должен составлять около 40-45 мл/мин, т. е. около 50% от нормы. Ф. В. Баллюзек отмечает хорошую "выживаемость" венозных шунтов по сравнению с артериальными. Через год наблюдения оказались проходимыми 6 из 13 шунтов. Основными осложнениями реваскуляризирующих вмешательств являются приапизм, тромбирование анастомозов, фиброз кавернозной ткани, что значительно снижает их эффективность и требует дальнейшего совершенствования.
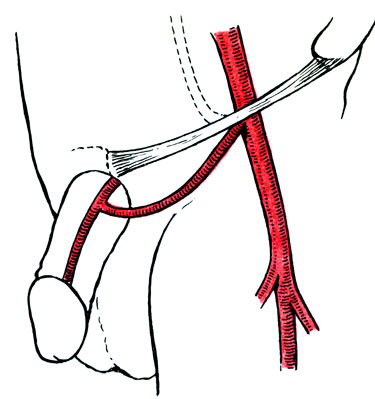
Рис. 63. Схема реваскуляризации артерий полового члена
Технически более сложными являются операции наложения прямых анастомозов с сосудами полового члена с использованием микрохирургической методики (рис. 63). При этом для реваскуляризации тыльных артерий полового члена используют нижнюю подчревную артерию. V. Michal и соавт. (1980), L. Crespo и соавт. (1984) применяли реваскуляризацию тыльных и (или) пещеристых артерий полового члена при помощи венозного аутологичного или гомологичного трансплантата, который присоединяли к наружной подвздошной или бедренной артерии. Ветви трансплантата (всего 2-3) присоединяли микрохирургическим методом к пораженным артериям полового члена, степень изменения в которых определялась ангиографически во время операции. Из 138 оперированных больных у 78,6% наступило излечение. У 81,7% причиной сосудистых нарушений был атеросклероз, у остальных выявлены диабет, врожденные отклонения, перелом таза. Операция обеспечивает создание более физиологических условий, чем прямая имплантация эпигастральных артерий в кавернозное тело.
Методы хирургической реваскуляризации полового члена проходят стадию развития, заключающуюся в усовершенствовании методики и совершенствовании техники оперативного вмешательства.
Устранение нарушений оттока крови. Патологическая утечка крови из пещеристых тел может явиться причиной нарушения эректильной функции у мужчин. Такое патологическое состояние может быть врожденным или приобретенным. Она может проявиться расстройством эрекции лишь с возникновением умеренной артериальной недостаточности. Проведение инфузионной кавернозографии помогает определить место утечки крови из пещеристых тел (по сосудам системы дорсальной вены, в спонгиозное тело головки и др.). В случаях обнаружения ускоренного венозного дренирования производятся различные виды оперативных вмешательств (перевязка глубокой тыльной вены полового члена; наложение артериовенозных шунтов между глубокой тыльной веной полового члена и нижней надчревной артерией или одной из артерий полового члена и др.). Наиболее простая операция - перевязка глубокой тыльной вены полового члена - дает низкий положительный результат. По данным J. Buvat и соавт. (1986), излечение наступило у 1 из 10 оперированных. Хорошие результаты получены при перевязке глубокой тыльной вены полового члена. A. Bennett и соавт. (1986) из 8 оперированных отметили восстановление сексуальной функции у 6 больных. Более сложными являются оперативные вмешательства с применением микрохирургической техники, направленные на коррекцию венозной и артериальной недостаточности, которые нередко сопутствуют друг другу. A. Bennett и соавт. (1986) предлагают в этом случае производить артериализацию глубокой тыльной вены полового члена с помощью нижней надчревной артерии и наложение свища между глубокой веной полового члена и одним из кавернозных тел. Осложнений при этой операции он не наблюдал, у всех больных отмечено выздоровление.
D. Hauri (1986) предложил накладывать соустье между одной из тыльных артерий и глубокой веной полового члена, затем с артериовенозным шунтом анастомозировали расщепленный дистальный конец ранее выделенной и перемещенной надчревной артерии. У 39 из 44 больных отмечено восстановление эректильной функции. Корригирующие оперативные вмешательства на сосудах, применяемые для лечения нарушений эрекции, являются патогенетически и функционально оправданными. Сравнительно недавно введенные в хирургическую практику, они требуют дальнейшей разработки и технического совершенствования.
Имплантирование протезов полового члена. Высокая техническая сложность и недостаточная эффективность операций, направленных на задержку оттока крови от полового члена, операций по усилению кровотока в половых органах и пересадке яичка препятствовали их широкому клиническому применению. Оперативное лечение, направленное на имплантацию протезов для достижения постоянной искусственной эрекции, является сравнительно простым, доступным способом для осуществления реальной помощи больным с эректильной импотенцией.
Впервые шинирование полового члена при фаллоплартике аутокостью применил Н. А. Богораз в 1936 г., используя для этого аутохрящ X ребра. В последующие годы продолжается поиск аллотрансплантатов. Наиболее пригодными и перспективными материалами, используемыми для фаллопластики, оказались медицинский полиэтилен, тефлон, силиконовые резины, некоторые металлы (серебро, тантал и др.). Наибольшее распространение в нашей стране получили протезы из полиэтилена марки 15803-020 (ГОСТ 16337-77) и силиконовой резины марки 52-336 (ЧТУ 38 03212-76).
Полиэтилен обладает достаточной механической прочностью, не вызывает биологических реакций в тканях. Силиконовая резина отличается эластичностью и упругостью при химической и биологической инертности. Эти материалы поддаются механической обработке и легко стерилизуются.
Основным показанием к имплантации протезов в половой член служат "органические" формы эректильной импотенции при невозможности либо неэффективности устранения причины нарушений эрекции. При "функциональных" психогенных формах эректильной импотенции фаллоэндопротезирование показано в случаях безуспешности квалифицированного консервативного лечения в течение нескольких лет. При этом должны быть приняты во внимание основное заболевание, имеющееся у данного больного, характер и степень мотивации, психологическое состояние, возраст.
Абсолютными противопоказаниями к оперативному лечению являются присутствие психопатологической симптоматики, слабый интеллект больного. Существуют способы внекавернозного (подкожное, межкавернозное, подфасциальное), внутрикавернозного (полное и частичное) и комбинированного протезирования полового члена.
Внекавернозная имплантация протезов в половой член осуществляется по-разному. Протез может быть введен подкожно или подфасциально по тыльной поверхности полового члена [Клепиков Ф. А., 1982; Jepson P., Silber J., 1973; Jacobs S., McCullough, 1974] или боковой его поверхности [Красулин В. В., Тараканов В. П., 1974; Карпов С. П., 1982; Красулин В. В., Коган М. И., 1982; Goodwin W. et al., 1981]. Другие хирурги располагают протез между кавернозными телами [Русаков В. И., 1970; Lash Н., 1968]. Межкавернозное фаллоэндопротезирование не получило широкого распространения из-за технически трудно осуществимого расслоения межкавернозной перегородки, заканчивающегося в конце концов повреждением пещеристых тел. Различные модификации протезов из-за сложности их фиксации не обеспечивали достаточной устойчивости и затрудняли интроекцию и фрикции. Наибольшее распространение получили менее травматичное подкожное или подфасциальное введения протезов. Приводим описание метода подкожного шинирования полового члена двумя боковыми полиэтиленовыми протезами [Красулин В. В., Тараканов В. П., 1974] (рис. 64).
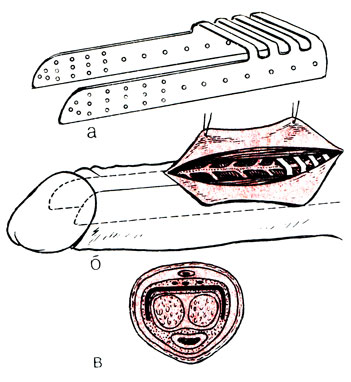
Рис. 64. Схема внекавернозного шинирования полового члена. а - заготовка из полиэтилена; б - оперативный доступ; в - расположение протеза в тканях полового члена
Сдвигают крайнюю плоть в проксимальном направлении. Под местной анестезией или общим обезболиванием двумя небольшими поперечными разрезами, проведенными по боковым поверхностям полового члена на уровне веночной борозды, рассекают кожу крайней плоти и подлежащие ткани до белочной оболочки. Держась за головку полового члена, зондом Кохера осторожно делают туннели до его основания. Придерживая острым крючком край головки, ножницами освобождают пещеристые тела до верхушки под головкой члена. В туннели вводят изготовленные полиэтиленовые шины и фиксируют их под головкой 2-3 капроновыми швами к белочной оболочке. Край головки опускают, и над шиной сшивают рассеченные ткани и кожу капроновой нитью. Центральный конец трансплантата, обращенный к корню полового члена, не фиксируют. Это обеспечивает свободное увеличение полового члена при эрекции. Авторы не рекомендуют делать отверстия по всей поверхности протеза, так как прорастание соединительной ткани в них способствует прочной фиксации протеза, не позволяет увеличиваться члену во время эрекции, делая ее резкоболезненной. Отверстия делают лишь у периферического конца протеза для облегчения фиксации его под головкой во время операции и более прочной его фиксации в будущем. После ушивания ран головку полового члена укрывают крайней плотью для профилактики парафимоза. Половой член бинтуют. Постельный режим на 1 сут. Швы снимают на 6-7-й день после операции. Половую жизнь запрещают на 6-8 нед, что вполне достаточно для организации прочной соединительнотканной капсулы вокруг протеза.
В. В. Красулин, М. И. Коган, Ю. В. Терентьев (1982) предлагают использовать для этой операции полиэтиленовый протез усовершенствованной конструкции. В связи с необходимостью помещения имплантата под головку полового члена под верхушкой кавернозного тела дистальному концу протеза придан определенный изгиб. Толщина протеза 3 мм по срединной продольной оси обеспечивает ригидность полового члена во время интроекции и фрикций. Длина изготавливаемых протезов 15 см, но для каждого больного он подбирается индивидуально, с учетом анатомических размеров полового члена. Протезы перед операцией стерилизуют в 2% растворе хлорамина или первомура в течение 2 ч.
Разнообразные способы внекавернозного протезирования дают много осложнений (отторжение протезов), неудовлетворительные косметические и функциональные результаты, что в последующем послужило причиной отказа от их широкого применения в клинике.
В последнее десятилетие завоевало наибольшее признание внутрикавернозное эндопротезирование, при котором более физиологично достигается имитация эрекции, обеспечиваются анатомические размеры органа и создается устойчивая возможность для проведения полового акта, уменьшается опасность отторжения имплантатов, расположенных глубоко в тканях.
Наиболее широко используются в настоящее время жесткие протезы [Pearman R., 1972; Morales P. et al., 1973; Красулина В. В. и др., 1984], полужесткие [Small М. et al., 1975; Jonas U., 1978] и надувные [Scott W. et al., 1973; Kessler R., 1980]. При изготовлении различных видов протезов используют биоинертные пластмассполимеры и силиконовую резину. Существует большое количество доступов к кавернозным телам (рис. 65). Они зависят от метода операции и имплантатов. К проксимальным отделам кавернозных тел пользуются промежностным, чрезлобковым стволовым (дорсальным, вентральным) и другими доступами. К дистальным отделам кавернозных тел используют поперечный окологоловчатый доступ. Приводим методику интракавернозной имплантации протезов [Красулин В. В. и др., 1984]. Протез выполнен в виде 3 разъемных частей, проксимальной длиной 35-45 и 55 мм (1), дистальной длиной 85-105 и 120 мм (2), изготовленных в виде стержней из медицинского полиэтилена с поперечным сечением 9-11 мм и соединенных эластичной муфтой (3) в виде гофрированной трубки, изготовленной из силиконовой резины (рис. 66).
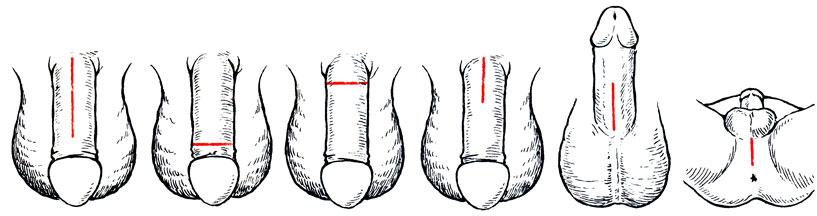
Рис. 65. Варианты доступов к кавернозным телам
Техника операции (рис. 67). На дорсальной поверхности полового члена у его основания в зоне проекции подвешивающей связки производят срединный разрез кожи длиной 3 см. Путем рассечения фасции поочередно обнажают белочную оболочку дорсально-латеральных поверхностей обоих кавернозных тел на участке из лобкового изгиба. Белочную оболочку одного из кавернозных тел берут на 2 капроновые держалки и между ними вскрывают на протяжении 1-1,5 см. Затем кавернозное тело бужируют расширителем Гегара от № 6 до № 9-11 в дистальном и от № 6 до № 8-10-в проксимальном направлении. С помощью бужей измеряют длину туннелей. Выбирают из комплекта протезов необходимые по размеру части. Соединяют муфту с проксимальной частью протеза и вводят их единым блоком в проксимальный туннель, дистальную часть протеза в дистальный туннель. Из разреза дистальную часть протеза соединяют с муфтой. Ушивают непрерывным хромкетгутовым швом рану белочной оболочки. Аналогичную технику используют при имплантации протезов в другое кавернозное тело. Контролируют симметричность положения дистальных концов протезов над головкой полового члена. Фасции полового члена ушивают отдельными кетгутовыми швами, а рану кожи - синтетическими монолитными нитями. После ушивания половой член неплотно бинтуют, укрывая головку крайней плотью, чтобы не допустить парафимоза. Назначают постельный режим на 2-3 сут. Швы снимают на 6-е сутки, и пациента выписывают на амбулаторное лечение. Рекомендуется воздержание от половой жизни в течение 6-8 нед.
Такая же техника операции применяется и при имплантации цельносиликоновых (полужестких) протезов типа Smoll-Carrion (1975), модифицированный В. В. Красулиным, М. И. Коганом, Ю. В. Терентьевым (1986) и изготовленного целиком из силикона - кремнийорганического каучука. В. К. Калнберз (1974, 1979) предложил более сложный фигурный протез для одновременного внутри- и внекавернозного его размещения. Однако для его имплантации необходима большая и относительно травматичная операция. Кроме того, Г. Я. Лернер и соавт. (1986) после применения Х-образного протеза В. К. Калнберза отмечают значительное (31,8%) число осложнений.
Надувные протезы имплантируют через промежностный или чрезлобковый доступы. В кавернозные тела вводят силиконовые цилиндры, которые через силиконовые трубки с клапанной системой соединены с резервуаром, содержащим жидкость, и насосом. Резервуар размещают над лобком, а насос - в нижней части мошонки. С помощью наcoca больной при необходимости может накачать расположенные внутрикавернозно цилиндры, регулируя степень напряжения полового члена. Частые осложнения при этих операциях связаны с механическими дефектами надувных протезов.
Тяжелым осложнением эндопротезирования полового члена является кавернит, который определяет показание к удалению протеза. По данным W. Furlow (1980), частота осложнений при чрезлобковом подходе для имплантирования надувных протезов была снижена до 6%.
Сложность конструкции протезов, требующих для производства специальной технологии, а также сложность и травматичность техники их имплантации стимулируют разработку менее сложных протезов и способов их имплантации с достижением более физиологичных результатов.
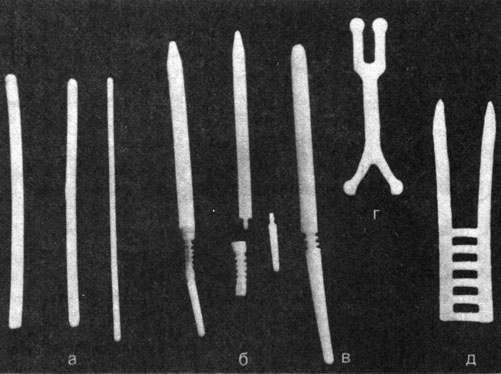
Рис. 66. Типы имплантантов. а - полиэтиленовые стержни диаметром 5, 7 и 9 мм для внутрикавернозного шинирования; б - разъемный протез из полиэтиленовых стержней с муфтой из силикона для внутрикавернозного шинирования; в - силиконовый цельный протез; г - полиэтиленовый протез Калнберза (располагается частично в кавернозных телах и частично между ними); д - заготовка для внекавернозного шинирования полового члена
Наиболее простым и технически доступным является способ неполного стержневого внутрикавернозного протезирования, предложенный М. Н. Зильберманом (1973). Для имплатанции используют стержни медицинского полиэтилена с поперечным сечением 8-9 мм с закругленными в виде полусферы концами.
Техника операции. После смещения в проксимальном направлении крайней плоти производится местная инфильтрационная анестезия 0,5% раствором новокаина. На тыльной поверхности полового члена вблизи венечной борозды производят поперечный (прямой или полуовальный) разрез кожи длиной 3-4 см. После обнажения рассекают белочную оболочку обоих пещеристых тел по переднебоковой поверхности на протяжении 1-1,5 см. Производят анестезию (20 мл 0,5% раствора новокаина) вскрытых пещеристых тел в проксимальном направлении длинной иглой с тупо срезанным концом, после чего в пещеристую ткань погружают монолитные полиэтиленовые стержни, доходящие промежностно до корневого изгиба пещеристых тел. Один из протезов может быть коротким и заполнять лишь подвижную часть пещеристого тела. В ране остается 2-3 см от их дистальных концов. Последние захватывают поочередно зажимом и погружают в головчатый отдел пещеристых тел. Разрезы белочной оболочки, фасции и кожи ушивают тонким капроном. Накладывают круговую умеренно давящую повязку. Швы снимают на 5-6-й день. Половая жизнь разрешается через 1 ½-2 мес после операции.
М. Н. Зильберман и Д. В. Свиренко (1987) при использовании стержней диаметром 8 мм хирургических осложнений не имели. Функциональный результат оказался успешным у 82,7% оперированных.
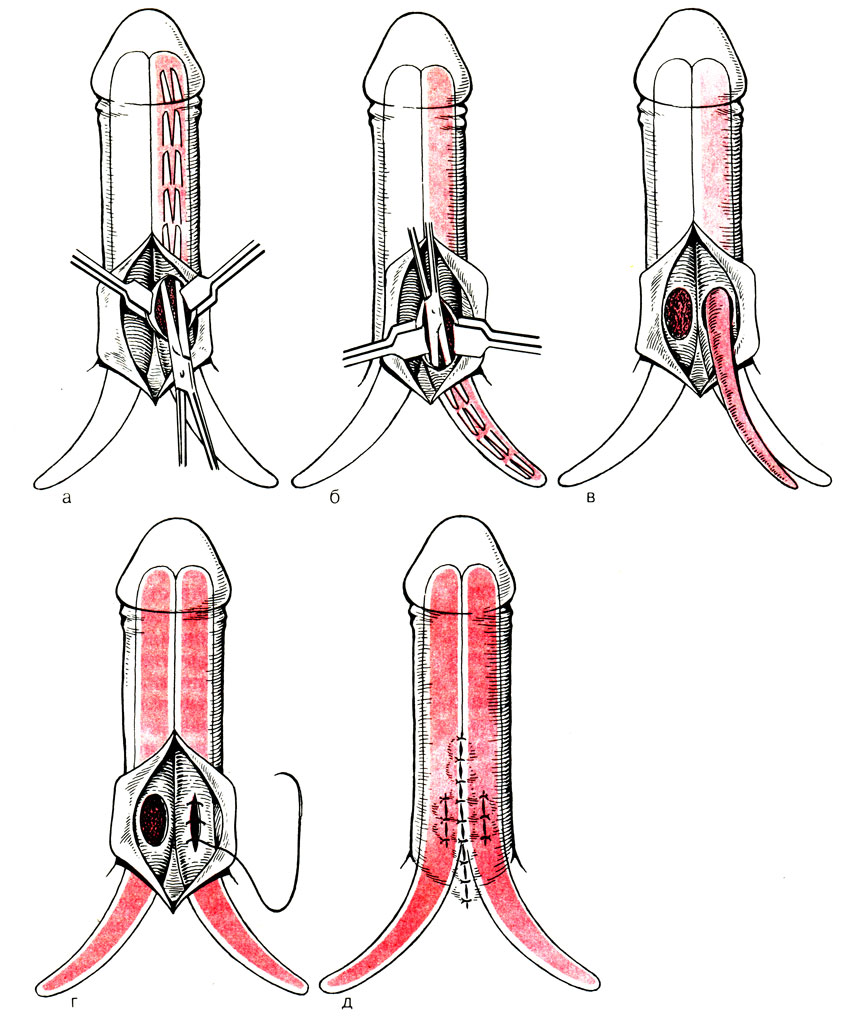
Рис. 67. Схема имплантации протезов в кавернозные тела (а - д)
По нашим данным, применение интракавернозного шинирования полового члена по методу В. В. Красулина, М. И. Когана, Ю. В. Терентьева, а с 1987 г. и по методу М. Н. Зильбермана у больных с эректильной импотенцией позволило отказаться от паракавернозного шинирования полового члена, дающего большое количество осложнений, при котором отторжение протеза отмечалось у 35% больных. При виутрикавернозном протезировании основным осложнением является пролабирование через головку или мочеиспускательный канал одного или обоих имплантатов, требующее их удаления, а при необходимости и реплантации. Пролабирование протеза, по нашим данным, происходит у 12% оперированных. При применении метода Зильбермана пролабирования протезов не отмечено. Положительный функциональный результат, который основывался на собственном мнении больного, отмечается у 87% больных, при этом либидо, характер семяизвержения и оргазма у больных, как правило, не менялись. Возможность продолжать половой акт после семяизвержения создавала предпосылку для достижения оргазма у половых партнерш. Большинство (70%) оперированных больных отмечают улучшение общего настроения, уверенность в общении с другими женщинами, стали активнее и лучше работать на производстве. В нескольких семьях родились дети.
Анатомические результаты не всегда удовлетворяли пациентов. Одной из причин этого были у 45% оперированных жалобы на недостаточные размеры органа, 50% указали на недостаточность объема полового члена, 35% обращали внимание на неудобство сокрытия полового члена под одеждой, на невозможность пользования баней, пляжем, заниматься спортом.
Приведенные сведения убеждают, что имплантация протезов в половой член является эффективным способом лечения тяжелых форм эректильной импотенции. Совершенствование конструкции протезов, техники оперативного вмешательства, психологическая реабилитация больных и коррекция половой дисфункции в послеоперационном периоде будут способствовать решению важной медико-социальной проблемы, какой является лечение половых расстройств у мужчин.
Хирургическая коррекция эндокринной импотенции. Среди самых актуальных, перспективных и патогенетически оправданных методов восполнения андрогенного дефицита является пересадка мужской половой железы. В последнее время пересадка яичка при эндокринной импотенции начинает входить в клиническую практику, однако существует значительное количество вопросов, нуждающихся в углубленном изучении.
Большинство авторов показаниями к пересадке яичка считают следующие: 1) потеря обоих яичек; 2) приобретенная гипофункция половых желез; 3) наличие эндокринной импотенции.
В настоящее время сложились 2 принципиально разных подхода к этой проблеме. С одной стороны, производится пересадка яичка как ткани, с другой - как целого органа. В связи с этим различают: 1) свободную пересадку и 2) пересадку на сосудистых связях [Кирпатовский И. Л., Горбатюк Д. О., 1986].
При свободной пересадке производились подкожные инъекции кашицы из ткани яичка, пересадка яичка кусочками различной величины, пересадка целого яичка.
Пересадку яичка на сосудистых связях выполняют в следующих вариантах: 1) пересадка на артериальной ножке; 2) пересадка на артериально-венозной ножке; 3) пересадка яичка на артериально-венозной ножке со сшиванием семявыносящего протока. При этом могут применяться аллотрансплантация (гомотрансплантация) и аутотрансплантация. Последняя применяется в клинической практике при травматических отрывах яичка, при крипторхизме.
Д. И. Кирпатовский, Д. Л. Горбатюк (1986) основным препятствием на пути к широкому использованию аллотрансплантации яичка, как и трансплантации других органов, считают реакцию тканевой несовместимости. Целый ряд экспериментаторов отметили, что трансплантаты от неполовозрелых или новорожденных животных не вызывают реакции тканевой несовместимости, что способствует их хорошему приживлению. С. С. Райцина (1970), О. А. Гоциридзе (1978) показали, что успех трансплантации неполовозрелых яичек связан с отсутствием в них активного сперматогенеза, так как клетки сперматогенного эпителия обладают выраженным антигенным свойством. Кроме реакции тканевой несовместимости, при трансплантации следует учитывать влияние расстройства кровообращения, денервацию трансплантата, нарушение оттока лимфы, роль места пересадки и влияние хирургической травмы.
Впервые в СССР пересадка яичка на сосудистой ножке была осуществлена А. П. Фрумкиным в 1947 г. Он сообщил о 3 случаях пересадок. Трансплантат от трупа вместе с сегментом аорты и нижней полой вены пересаживался на бедро. Кровоснабжение восстанавливалось путем наложения анастомозов с бедренной артерией и веной.
В 1965 г. Т. Е. Гнилорыбов и В. 3. Нехвядович производили пересадку яичка, сшивая артерию трансплантата с глубокой артерией бедра реципиента, а вену яичка с большой подкожной веной бедра (5 наблюдений). Другой вариант предусматривал наложение указанных анастомозов и сшивание семявыносящего протока.
И. Д. Кирпатовский и соавт. (1970) приводят данные о 13 пересадках яичка на артериально-венозной ножке. Сосудистый анастомоз производился между семенными сосудами трансплантата и нижними эпигастральными артерией и веной.
Известны сообщения также о единичных пересадках на сосудистых ножках А. Д. Тохияна (1952), В. С. Гехмана (1964) и др. Наиболее отработанной и широко используемой в клинической практике является пересадка яичка с подключением сосудов трансплантата к нижним надчревным сосудам реципиента по Д. И. Кирпатовскому, методика которой приводится ниже.
Методика орто- и гетеротопической трансплантации яичка на артериально-венозной ножке описана И. Д. Кирпатовским, Д. Л. Горбатюком в 1986 г. и включает 3 этапа: 1) забор трансплантата яичка от донора; 2) подготовка кровеносных сосудов реципиента; 3) собственно пересадка яичка.
Забор трансплантата яичка имеет некоторые особенности по сравнению с обычной орхифуникулэктомией. Доступ к яичку и семенному канатику осуществляется путем разреза кожи, подкожной жировой клетчатки и апоневроза наружной косой мышцы, проводимого параллельно паховой связке и на 2 поперечных пальца выше ее от уровня верхней трети паховой связки до корня мошонки. Тщательно мобилизуют яичко с придатком, семенным канатиком в их оболочках до внутреннего отверстия пахового канала. Сосуды яичка мобилизуют и пересекают на 5-6 см проксимальнее глубокого отверстия пахового кольца. Яичковую артерию маркируют шелковыми лигатурами. Семенной канатик с остальными его элементами пересекают на уровне глубокого пахового кольца.
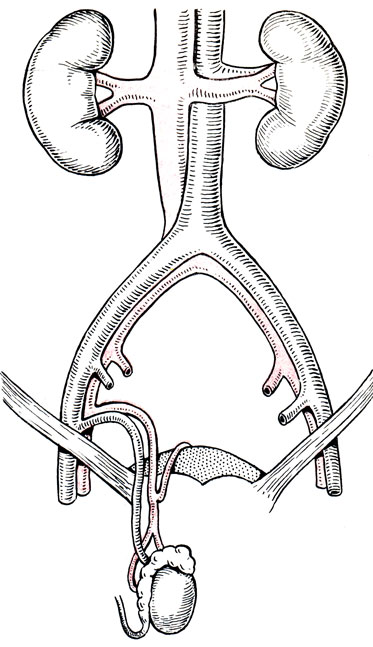
Рис. 68. Схема пересадки яичка с расположением трансплантата в мошонке
Следующий этап состоит в выделении у реципиента нижней надчревной артерии, вены и их подготовке к соединению с сосудистой ножкой трансплантата. Дугообразным разрезом, открытым в сторону средней линии живота, послойно рассекают мягкие ткани реципиента. Вертикальную часть разреза начинают чуть ниже пупочного кольца по наружному краю прямой мышцы живота, горизонтальную проводят по проекции пахового канала. Рассекают заднюю стенку пахового канала (поперечную фасцию) и переднюю стенку влагалища прямой мышцы живота. Обнажают нижнюю надчревную артерию и вену на протяжении от уровня пупочного кольца до паховой связки. Производят мобилизацию сосудов и их ревизию для выбора уровня пересечения сосудов, на котором их диаметр соответствовал бы диаметру сосудов трансплантата. Затем нижнюю надчревную артерию и вену пересекают. Проксимальные отрезки сосудов готовят к наложению анастомозов, а дистальные раздельно лигируюг. Этот этап целесообразно выполнить до прекращения кровоснабжения донорского яичка (если используется живой донор), чтобы уменьшить время ишемии транспланата.
Собственно пересадка яичка включает восстановление кровоснабжения в трансплантате и анастомозирование семявыносящего протока (при условии, предусматривающем восстановление репродуктивной функции пересаженного органа). При ортотопической пересадке трансплантат яичка помещают в мошонку, а его семенной канатик в паховый канал. Проксимальные отрезки нижней надчревной артерии и вены перемещают в направлении пахового канала и анастомозируют их с сосудами трансплантата. В дальнейшем производятся пластика пахового канала и послойное ушивание операционной раны (рис. 68).
При гетеротопической пересадке яичко после наложения сосудистых анастомозов располагают в подкожной жировой клетчатке передней брюшной стенки, к которой яичко фиксируют швами за влагалищную оболочку. Рану послойно ушивают.
В последние годы интенсивные разработки проблемы трансплантации яичка, как в теоретическом, так и в клиническом направлении, ведутся под руководством И. Д. Кирпатовского в клиническом центре андрологии и пересадки эндокринных органов Университета дружбы народов им. П. Лумумбы. Разработана в эксперименте модель одномоментной пересадки двух яичек, при которой осуществляется ортотопическое расположение трансплантатов, сводится к минимуму (2 анастомоза) количество сосудистых анастомозов, исключается необходимость соответствия диаметра сосудов реципиента и трансплантата [Кирпатовский И. Д., Горбатюк Д. Л., 1986]. Однако в целом проблема трансплантации яичка остается до конца не решенной. Результаты исследования свидетельствуют о возможности приживления аллотрансплантированных семенников, взятых от половозрелых животных и пересаженных на артериально-венозных ножках. Но нарастание реакции тканевой несовместимости приводит через 2 нед к отторжению трансплантатов. Из других осложнений отмечаются нагноение раны, тромбоз, секвестрация, в связи с чем важное значение должно придаваться подбору доноров и реципиентов по иммунологическим показателям, иммунодепрессивной терапии, технике оперативного вмешательства и профилактике сосудистых тромбозов.
В клинике производится аллотрансплантация яичка на артериовенозной сосудистой ножке для коррекции эндокринных форм импотенции. Аутотрансплантация яичка применяется при абдоминальной форме крипторхизма, пересадка неонатального аллогенного яичка на сосудистых связях больным грудного и раннего детского возраста в условиях посткастрационного синдрома и постнатальной гипоплазии яичка для предупреждения развития у них гипогонадизма [Кирпатовский И. Д., Горбатюк Д. Л., 1985].
Б. М. Хромов (1974) считал, что пересадка органов и тканей является не столько хирургической, сколько в основном биологической и патофизиологической проблемой. Если подходить к пересадке яичка с позиции трансплантации органа, то следует стремиться сохранить его анатомическую целость, функциональную полноценность, что может быть достигнуто лишь при обеспечении адекватного кровообращения, сохранении его оболочек, естественного для него расположения. При аллотрансплантации важное значение имеет подавление реакции тканевого иммунитета. Поскольку жизнеспособность и функционирование органа ограничены во времени, из-за функционирования органа в нефизиологических условиях (денервация, нарушение лимфооттока и др.) аллотрансплантация яичка остается пока паллиативным вмешательством.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'