Глава 18. Бесплодие у мужчин (Михайличенко В.В.)
Проблема мужского бесплодия в последние годы приобретает особую медицинскую и социальную значимость как у нас в стране, так и за рубежом. Это связано с увеличением частоты заболеваний половых органов у мужчин, ростом аномалий развития, обусловленных влиянием вредных факторов внешней среды, аллергизацией населения, широким и бесконтрольным применением лекарственных средств и другими факторами. Нарушение фертильности приводит к росту бесплодных браков, малодетных семей, разводов и ухудшению демографических показателей. Удельный вес бесплодных браков в мире достигает 15%, причем половина из них обусловлена бесплодием мужчин.
Этиология. Бесплодие у мужчины возникает в результате многочисленных патологических процессов в организме, которые вызывают дистрофические изменения в семенных канальцах и межуточной ткани яичек, приводя к развитию патоспермии и нарушению секреции половых гормонов.
Нервно-психический фактор. Нормальный ход сперматогенеза регулируется сложными процессами, которые необходимо рассматривать с точки зрения целостного организма, а не как нечто местное, локальное. Нейроэндокринная регуляция половой функции мужчин обеспечивается прежде всего системой кора головного мозга - гипоталамус - гипофиз - семенники. Кроме того, в этом сложном процессе участвуют и другие эндокринные железы, обеспечивающие нормальное развитие полноценной семенной клетки.
В большинстве случаев ЦНС первой среди других систем организма реагирует, обеспечивая существенные изменения в метаболизме. Это происходит чаще всего с участием промежуточных звеньев гипоталамуса и гипофиза.
Тяжелая психическая травма, воздействуя через половой центр гипоталамуса, нередко приводит к олиго- или азооспермии. С другой стороны, нарушения внутрисекреторной функции яичек также влияют на процессы возбуждения и торможения в коре головного мозга. Следует также помнить о том, что нервные центры гипоталамуса чрезвычайно чувствительны к действию любых, даже незначительных, патологических агентов. Это объясняет механизм развития бесплодия при некоторых диэнцефальных поражениях. На первом месте здесь, видимо, стоят коммоционная и иная травма, подострые и острые нейроинфекции, алкоголизм. Серьезные повреждения семенного эпителия яичек, возникающие при травме спинного мозга, зависят также от степени и места повреждения. После поражения головного и спинного мозга в яичках наблюдаются десквамация и вакуолизация зародышевых клеток, атрофия семенных канальцев, подавление и прекращение сперматогенеза, а также снижение уровня тестостерона в моче. Важное значение придается вегетативной нервной системе, которая имеет влияние не только на потенцию, но и на сперматогенез. Психические стрессы нарушают гармонию вегетативной нервной системы и даже при нормальном состоянии яичек могут привести к психической стерильности, азооспермии. Повреждение n. ileoinguinalis, возможное при грыжесечении или вследствие рубцовых изменений в послеоперационном периоде, может привести к дегенерации и даже атрофии яичек.
Врожденные и генетические причины. В последние десятилетия отмечается значительный рост количества врожденных патологических изменений яичек, которые достигли в настоящее время 4-5%. Врожденные и хромосомные
аномалии развития половых органов, приводящие к бесплодию у мужчин, описаны в соответствующих разделах руководства (крипторхизм, монорхизм, анорхизм, дисгенезия половых желез и др.).
Инфекционно-токсический фактор. Патологическое влияние на яичко при всяком инфекционном заболевании может оказать как инфекционный возбудитель, так и токсин и тепловой фактор [Порудоминский И. М., 1968].
Важная роль в этиологии бесплодия отводится таким заболеваниям, как эпидемический паротит, сыпной, брюшной тифы, малярия, туберкулез, бруцеллез, пневмония, сепсис, венерические заболевания и др. Частота бесплодия у мужчин после перенесенных инфекционных болезней колеблется, по данным разных авторов, от 8,5 до 36%. Инфекционные заболевания среди мужчин с пониженной оплодотворяющей способностью спермы встречаются в 70% случаев.
Особое место в мужском бесплодии занимает эпидемический паротит, который нередко осложняется орхитом. Это осложнение развивается в ходе самого заболевания. При этом поражаются все ткани яичка. Но особо выраженным нарушениям подвергаются его паренхима и семявыносящие канальцы, соединяющие яичко с головкой придатка.
Острый орхит отмечается у 5-15% мужчин, заболевших в период возмужания эпидемическим паротитом. У взрослых орхит после паротита наблюдается в 18% наблюдений, причем он может осложниться эпидидимитом, т. е. развивается орхоэпидидимит. У 1/3 больных паротит осложняется орхитом, при этом эпидемический паротит может вызывать нарушения в паренхиме яичек почти в половине наблюдений при отсутствии клинических проявлений орхита.
Орхитами, хотя и реже, осложняются и другие инфекционные заболевания (брюшной тиф, паратиф, бруцеллез, грипп, сепсис и др.). Особенно вредным оказывается токсическое влияние на сперматогенный эпителий в случае перенесения нескольких тяжелых инфекционных заболеваний или хронических инфекций. При этом важная роль в патогенезе бесплодия отводится повреждению гематоорхического барьера и развитию аутоиммунного асперматогенеза.
В результате действия болезнетворных возбудителей образуются продукты распада, которые, в свою очередь, влияют на трофику яичек. К нарушению сперматогенеза могут привести изменение состава крови, патогенное влияние на функцию яичек инфекционного возбудителя, токсинов, высокой температуры тела, сопровождающей острые инфекционные заболевания, а также повреждения печени, особенно при инфекционном гепатите.
Экзогенные интоксикации. Возрастающая индустриализация привела к тому, что химические и другие профессиональные вредности занимают значительное место в этиологии бесплодия. Проблема экзогенных интоксикаций особую актуальность приобрела в последние годы, когда в цивилизованных странах сложилась "токсическая ситуация": накопление в окружающей среде большого количества химических веществ, применяемых для производственных, бытовых, медицинских и других целей.
Хронические и острые интоксикации могут оказывать как прямое (первичное) воздействие на генеративную ткань яичка, так и непрямое (вторичное) - вследствие нарушения барьерной функции печени, а также вредного воздействия на ЦНС. Яды могут вызывать также клеточную асфиксию вследствие конкурентного вытеснения кислорода в молекуле гемоглобина и вследствие токсического поражения эритроцитов. Не меньшее значение, вероятно, имеет и тканевая гипоксия, тесно связанная с метаболическим ацидозом и прямым угнетающим влиянием токсических веществ на дыхательные ферменты.
Большое количество различных химических веществ и продуктов биологического синтеза в среде обитания человека обусловлено высокими темпами научно-технического прогресса. Ежегодно к 2 млн уже зарегистрированных химических веществ добавляется 250 тыс. новых, из которых около 500 внедряется в практику в виде лекарственных препаратов, пищевых добавок, пестицидов, промышленных соединений. Часть из них, как показали экспериментальные исследования, могут индуцировать мутации.
Как правило, человек подвергается воздействию различных физических, химических мутагенов в небольших дозах, хронически или эпизодически, т. е. фракционированно. В этом смысле интересна работа Л. В. Бондаренко и соавт. (1978), доказывающая, что частота мутаций при фракционированном действии этиленамина и этиленэтансульфанатана на мужские половые железы Drosophilae выше, чем при непрерывном воздействии.
Ряд профессиональных и других интоксикаций оказывают вредное влияние на зародышевый эпителий яичка. Поэтому рекомендуется особое внимание придавать условиям работы мужчин, имеющих контакт с промышленными ядами, такими как свинец, ртуть, марганец, фосфор, сероуглерод, этиленамин, аммиак, бензол, гранозан, органические перекиси и др. Постоянная работа с этими веществами постепенно может привести к поражению весьма чувствительного герминативного эпителия яичек.
Не исключается возможность поражения яичек в результате кислородной недостаточности и хронической интоксикации в больших городах выхлопными газами двигателей, промышленным дымом на фоне психического напряжения и переутомления.
Применение некоторых лекарственных препаратов: сульфаниламидов, целого ряда антибиотиков, нитрофуранов - оказывает отрицательное воздействие на сперматогенный эпителий, что может приводить к бесплодию у мужчин. Установлена также роль избыточных доз хорионического гонадотропина в развитии гиалиноза семенных канальцев. Препараты, блокирующие α-рецепторы, могут вызвать сокращения семявыносящих протоков, ампулы и семенных пузырьков, вызывая обструктивную аспермию.
Гентамицин, окситетрациклин, цефалоспорин, колимицин, калиевая соль пенициллина, триметаприм и др. в различной степени угнетают сперматогенез, прекращается частично или полностью деление сперматогоний, и нарушается мейоз сперматоцитов первого порядка, нитрофураны иммобилизуют спермин. В эксперименте на крысах, применяя терапевтические и токсические дозы неомицина, стрептомицина и тетрациклина, Ю. И. Кушнирук (1973) отметил отрицательное их влияние на функциональное состояние спермиев (увеличение патологических форм и снижение времени подвижности). При гистологическом исследовании препаратов яичка автор отмечал поражение самых молодых клеток семенного эпителия и уменьшение суммарного числа сперматогоний.
Применение андрогенов, эстрогенов и кортизона подавляет митозы, что ведет к нарушению сперматогенеза и бесплодию. Эстрогены действуют на паренхиму яичка не как специфический гормон другого пола, а только как гистохимически токсичный, подавляющий зародышевую ткань, что приводит к ее атрофии и регрессу. При назначении кортизона в период половой зрелости очень быстро появляется недостаточность яичек, причем изменения могут быть необратимыми. Отрицательно влияют на сперматогенез такие вещества, как тиоурацил, актиномицин, производные этиленамина, цитостатики, а также нитрофураны.
Привычные интоксикации. В практическом отношении важное значение имеет злоупотребление алкоголем и табаком. У лиц, страдающих алкоголизмом, определяются выраженные изменения в эякуляте, которые сводятся к увеличению неподвижных и патологических форм спермиев.
На основании клинических и экспериментальных исследований у лиц, страдающих хроническим алкоголизмом, наблюдаются жировая дегенерация зародышевого эпителия и разрастание соединительной ткани в яичке.
При этом большое значение придается повреждающему действию алкоголя на печень, что в конечном итоге приводит к вторичному выпадению функции яичек.
Злоупотребление курением также приводит к дегенеративным изменениям зародышевого эпителия яичек. Сосудосуживающее действие никотина ведет к ухудшению питания чувствительности паренхимы яичек. На нарушение способности к оплодотворению может влиять свойство никотина понижать тонус мускулатуры семявыносящих путей и придаточных половых желез.
Нельзя отрицать того, что токсические вещества оказывают не только непосредственное вредное воздействие на паренхиму яичек, но и опосредованное - через повреждение антитоксической функции печени, почек, а также вследствие тонического воздействия на различные структуры центральной и периферической нервной системы.
Алиментарный фактор. Важную роль в процессе сперматогенеза играет пищевой фактор. Недостаточное питание, полное или частичное голодание рано приводят к изменениям в яичках. Эти изменения особенно значительны у детей и подростков до периода полового созревания. Особое значение имеют белки, незаменимые аминокислоты (аргинин, триптофан, лизин, метионин, лейцин и др.) и витамины (А, С, D, Е). Уменьшение содержания этих веществ в пище вызывает расстройства потенции, а также генеративной функции.
Дегенеративные изменения возникают не только в яичках, но и в гипофизе, в гипоталамо-гипофизарной системе. Особенно значительно подавляется гонадотропная функция гипофиза. Первичное повреждение яичек на фоне гипофизарной недостаточности приводит при длительном голодании к необратимым дегенеративным изменениям семенных канальцев.
Для развития половых желез и нормального сперматогенеза необходимо достаточное поступление в организм целого комплекса витаминов. Важное значение придается витаминам А, С, D, Е, Р, В и др. Особое значение следует придавать питанию в период полового созревания, а также при острых и хронических инфекционных заболеваниях, предъявляющих повышенные требования к ослабленному организму.
Влияние ионизирующего излучения. В связи с интенсивным использованием атомной энергии, радиоактивных нуклидов, широким применением рентгенодиагностических, радионуклидных методов исследования особое значение в этиологии мужского бесплодия приобретают различного рода ионизирующие излучения.
Сперматогенный эпителий обладает высокой чувствительностью к ионизирущему излучению. При этом гибель зародышевых клеток происходит от периферии канальца к центру, так как наиболее чувствительными являются молодые клетки сперматогенного эпителия (сперматогонии). Более резистентны сперматиды, и еще большей физиологической устойчивостью к ионизирующему излучению обладают зрелые спермин [Нигли Ф., 1961]. Сперматогонии также обладают различной чувствительностью к облучению, поэтому часть клеток могут остаться жизнеспособными даже после облучения большими дозами. Сохранившиеся сперматогонии по снятии блоков их митотической активности продолжают участвовать в процессе сперматогенеза.
Для человека временно стерилизующей дозой является 645·10-4 Кл/кг. В таком случае через год эякулят может стать близким к норме. Необратимое бесплодие наступает при локальном облучении в дозах, превышающих 1290·10-4 Кл/кг. Особенно тяжелые расстройства вызывают γ-лучи.
Важно отметить, что облучение может не только быть непосредственной причиной бесплодия, но и приводить к аномалиям сперматогенеза у потомков облученных в результате мутагенного воздействия на хромосомы (химическое изменение гена). Повторные воздействия приводят к постепенному усилению (кумуляции) вредных изменений.
Половые железы являются органом, где наиболее отчетливо проявляется кумулятивный эффект хронического или фракционированного облучения. Возможно, такой факт имеет наибольшее значение в организме матери, так как пожилой возраст способствует появлению изменений в хромосомах.
Перечень внешних воздействий, вызывающих мутации, все увеличивается по мере их дальнейшего изучения в эксперименте. Сюда, кроме действия рентгеновских лучей, γ-лучей, относят и другие виды ионизирующего излучения. Дополнительно действующими мутагенными моментами считаются ультрафиолетовое излучение, изменения температуры и влажности, а также целый ряд химических соединений.
Таким образом, стерильность, возникающая при действии ионизирующих излучений и химических мутагенов, обусловлена поражением генетического аппарата клеток сперматогенеза, что приводит к азооспермии и к нарушениям морфологии семенника. Повреждение генетического аппарата зрелых спермиев может привести к хромосомным заболеваниям у потомства.
Нарушения функции эндокринных и других внутренних органов (щитовидной железы, надпочечников, эпифиза, поджелудочной железы), а также заболевания гипофиза и других желез внутренней секреции также вызывают изменения функции яичек. Эти изменения при невыраженности симптомов основного заболевания, как правило, не достигают степени азооспермии, а при выраженности эндокринных заболеваний вопрос обычно ставится не о восстановлении плодовитости, а о лечении основного заболевания под наблюдением эндокринолога.
Корреляция эндокринных нарушений приводит и к улучшению сперматогенеза. Основным путем транспорта половых гормонов от половых желез является кровь, откуда обеспечивается их поглощение тканями, в которых происходит их интенсивный метаболизм. Жировая ткань служит своего рода депо для половых гормонов. В их метаболизме активно участвуют печень, почки, кишечник, легкие, кожа.
Особенно активно процессы метаболизма стероидов происходят в печени. Через желчный проток продукты метаболизма половых гормонов попадают в кишечный тракт; часть из них, всасываясь, попадает обратно в печень, другая часть выводится с калом. Значительное количество метаболитов половых гормонов в виде 17-КС выделяется через почки с мочой.
Указанные процессы могут протекать благоприятно лишь при нормальном тканевом дыхании (поглощение тканями кислорода и выделение углекислого газа). Расстройства внешнего дыхания вызывают изменения процессов внутриклеточного дыхания.
Поэтому немаловажное значение в возникновении бесплодия придается заболеваниям печени, таким как инфекционный гепатит, циррозы и пр., заболеваниям почек, сопровождающимися ХПН, легких (хронические пневмонии, бронхоэктазии).
Влияние температуры. Сперматогенез нормально протекает при температуре на 2...3 °С ниже температуры тела. Чрезмерное тепло вызывает повреждение молодых зародышевых клеток в процессе деления и при длительном воздействии приводит к дегенерации паренхимы яичек. Известно, что перемещение семенников в брюшную полость неизбежно ведет к перерождению структуры в связи с изменением обычного для яичек температурного режима. Повреждающему действию теплового фактора придается большое значение при крипторхизме, при лихорадочных состояниях, обусловленных различными инфекциями. Кратковременное повышение температуры тела свыше 39° С может серьезно угнетать сперматогенез. Нормальное содержание спермиев в эякуляте наступает только через 2 ½ мес. Обнаружено, что у людей, работающих в условиях высокой температуры (кочегары, литейщики, пекари и т. д.) тормозится процесс сперматогенеза. Об отрицательном тепловом влиянии содержимого грыжи на яички сообщает И. М. Порудоминский (1968).
Местное повышение температуры при варикоцеле, грыже, также отрицательно влияет на сперматогенный эпителий.
Однако при варикоцеле, грыже и водянке на яичко воздействуют и другие вредные факторы: нарушение кровообращения, гипоксия, механическое давление, а также возможное нарушение гематотестикулярного барьера, осуществляющего иммунологическую защиту от аутоантигенных клеток в физиологических условиях. Совместное вредное воздействие патологических факторов и вызывает дегенерацию зародышевых клеток яичка, а также приводит к нарушению гормональной функции его. У больных с варикоцеле при двусторонней биопсии яичек обнаруживается тяжелое поражение канальцев вплоть до развития вторичного "синдрома только зародышевых клеток". Сустентоциты имеют признаки перерождения и атрофии.
Низкая температура также вызывает повреждение сперматогенного эпителия. Достаточно подвергнуть обнаженное яичко воздействию температуры ниже 4-6 °С или через мошонку температурой ниже -10 °С в течение 1 ч, чтобы вызвать нарушение сперматогенеза. Вследствие высокой чувствительности зародышевого эпителия к термическим влияниям в первую очередь страдает генеративная функция, в то время как гландулоциты яичка, оставаясь неповрежденными, сохраняют его андрогенную функцию.
Влияние сосудистых нарушений на функцию яичка. Секреторная и инкреторная функции яичка зависят прежде всего от их нормального кровоснабжения. Анатомическое строение сосудистой системы является важным приспособлением для сохранения в них постоянства температуры и стабильности сперматогенеза.
Сосудистые нарушения в яичках имеют большое значение в развитии поражения генеративного эпителия и гландулоцитов. Функциональная недостаточность яичек, развивающаяся вследствие сосудистых нарушений, объясняется высокой чувствительностью сперматогенного эпителия даже к кратковременной ишемии.
В опытах на животных показано, что тяжелая степень поражения сперматогенного эпителия обнаружена после временного выключения из кровообращения семенников на протяжении 40 мин.
Выключение из кровообращения яичек в течение 240 мин обусловливает необратимую атрофию сперматогенного эпителия. Степень ишемического повреждения яичек находится в прямой зависимости от пубертатной зрелости животного, от длительности и степени ишемии. Гипоксия при длительном воздействии также приводит к асперматогенезу. Причем ишемический и гипоксический асперматогенез является аутоимунным процессом. Бесплодие при водянке яичка объясняется тем, что давление накопившейся между оболочками жидкости ведет к атрофии извитых семенных канальцев, сопровождающейся заметным снижением сперматогенеза и разрастанием соединительной ткани, что сказывается на репродуктивной функции яичка. Неполноценностью периферического кровообращения объясняется угасание функции половых желез у мужчин при физиологическом старении. В результате прогрессирующего ухудшения кровообращения и питания яичка с возрастом значительно падает активность сперматогенной и андрогенной функции. Развиваются явления перитубулярного, а затем и тубулярного склероза с облитерацией канальцев, постепенно уменьшается количество клеток Лейдига в межуточной ткани.
Веностаз в половых органах, который развивается вследствие почечной венной гипертензии, аномалий строения мочеполового венозного сплетения и других заболеваний ретроперитонеального пространства и полости таза, может приводить к гипоксии, нарушению тканевого дыхания, к изменению физиологической функции яичек и придаточных половых желез с развитием бесплодия.
Травма. Травмы половых органов в зависимости от характера и силы могут привести к необратимым изменениям в структуре и функции яичек. Повреждение только придатков, сопровождающееся кровотечением, некрозом, воспалением, может привести к облитерации семявыносящих путей при сохраненной сперматогенной и инкреторной функций яичек. Однако повреждение кровеносных сосудов, сдавление их гематомой, приводящее к ишемии, повреждение нервных окончаний, сопровождающиеся нарушением трофики, могут вызвать необратимые изменения как в паренхиме, так и в межуточной ткани [Михайличенко В. В., 1983].
О. Л. Тиктинский и В. В. Михайличенко (1983) настаивают на раннем оперативном лечении подкожной травмы яичек. Такая тактика позволяет ликвидировать гематомы, сдавливающие питающие сосуды, а также повреждение белочной оболочки, которое в дальнейшем может привести к аутоиммунной аспермии.
Операции на влагалищных оболочках яичка и семенном канатике могут отрицательно влиять на паренхиму яичка и нарушать образование спермиев. Эти нарушения в большинстве случаев необратимы и заканчиваются атрофией семенных канальцев. Ввиду этого оперативные приемы на яичке и его оболочках должны быть наименее травматичными.
У 2% обследованных по поводу бесплодия больных возможной причиной заболевания являются перенесенные в прошлом грыжесечения. К частичной или тотальной стерилизации может приводить травма, возможная при операциях по поводу грыжи, когда в отдельных случаях происходит сжатие сосудов, питающих яички, или же случайная перевязка сосудов и семявыносящих протоков. Придается значение венозному застою, который может наступить после грыжесечения, за счет сдавления семенного канатика тугими швами или наступающим в паховом кольце рубцеванием, что приводит к перерождению ткани яичек и их атрофии.
Представленные данные позволяют считать, что герминативный эпителий чрезвычайно чувствителен к ишемии.
Большое значение приобретает тот факт, что увеличение или уменьшение тока крови в одном яичке вызывает рефлекторным, а может быть, трансскротальным путем изменения в другом яичке.
Важное значение при травме, ишемии, воспалении, воздействии токсических веществ, а также при температурных влияниях придается нарушению гематоорхического барьера. Этим можно объяснить нарушения сперматогенеза в интактном яичке при патологическом процессе в контралатеральном.
Нарушение гематоорхического барьера. Накапливается все больше фактов, указывающих на важную роль аутоиммунных процессов в патогенезе асперматогенеза.
Нормальная функция сперматогенных клеток возможна только благодаря наличию особого, обладающего селективной проницаемостью, барьера между кровью и содержимым семенных канальцев, гематотестикулярного барьера. Термин "гематотестикулярный барьер" введен в литературу В. Setchell в 1967 г.
Изменение проницаемости гематотестикулярного барьера, образованного собственной оболочкой семенных канальцев и цитоплазмой клеток Сертоли, играет существенную роль в патогенезе аутоиммунного бесплодия. Следует помнить, что гематотестикулярный барьер хорошо развит у мужчин, слабо - у детей и ослабляется с возрастом. Переохлаждение, перегревание, ишемия, общие инфекции, травмы, авитаминозы, голодание и др. способствуют его разрушению.
Созревающие сперматиды и особенно спермин обладают антигенными свойствами. Поэтому нарушение гематотестикулярного барьера приводит к образованию в крови антител к сперматогенному эпителию семенных канальцев с развитием аутоиммунного бесплодия.
Следует помнить, что гематотестикулярный барьер выполняет как защитную, так и трофическую функцию, поэтому нарушения в структуре не только делают проницаемым барьер для Т-лимфоцитов и антител, чужеродных и токсических веществ, но и резко ухудшают трофику клеток сперматогенного ряда. Это ухудшение защитной и трофической функций барьера особенно выражено при аутоиммунном орхите, а также при старении и, очевидно, является одной из основных причин возрастного угасания сперматогенеза.
J. Larkin (1960) установлено, что трансплантаты семенников крысиных эмбрионов и новорожденных крыс сохраняют способность восстановления структуры в различные сроки после трансплантации, в то время как трансплантаты семенников от половозрелых животных подвергаются гибели уже через 2 нед после трансплантации. Повторные пересадки зрелых семенников ускорили процесс отторжения вторичных трансплантатов.
При повторных пересадках эмбриональных трансплантатов такой реакции не наблюдалось.
С. С. Райцина и соавт. (1963, 1973) доказали в эксперименте, что повреждение яичка сопровождается нарушением целости структур, изолирующих сперматогенный эпителий от иммунологически компетентных клеток. Контакт с последними приводит к развитию аутоиммунного процесса и характеризуется появлением в сыворотке крови животных антител к ткани яичка с цитотоксическими свойствами.
Посттравматическая деструкция сперматогенного эпителия не происходит в том случае, если к моменту травмы в яичке отсутствовали аутоантигенные клетки (сперматоциты, сперматиды, спермии), что имеет место, например, у молодых животных и у животных с искусственным асперматогенезом, получавших длительное время эстрогены (синэстрол).
Развитию посттравматического асперматогенеза препятствуют воздействия, снимающие иммунную активность организма. К ним относятся повторные инъекции кортизона, салицилатов и индукция иммунологической специфической толерантности к антигенам яичка, сохранение структур, выполняющих роль иммунологических барьеров при нанесении травмы.
Регенерация сперматогенного эпителия происходит за счет митотического деления сперматогоний, сохраняющихся в составе эпителия канальцев яичка.
О. А. Гоциридзе (1978) при пересадке семенников половозрелых самцов обеспечивает эвакуацию спермы либо путем реканализации семявыносящих протоков, либо путем выполнения вазостомии. Этим достигается эвакуация спермиев, несущих в себе сильные трансплантационные антигены.
Резорбция спермиев в очаге воспаления может способствовать появлению аутоиммунных реакций. В связи с большой поражаемостью яичек при сочетанием бесплодии можно говорить о первичной аутоиммунной реакции к спермиям [Чернышов В. П., 1979]. Антитела у самцов скапливаются в сперматогенном эпителии, нарушая тем самым процессы сперматогенеза.
На основании имеющихся данных становится очевидным, что при нарушении гематотестикулярного барьера возможно попадание семенниковых антигенов в кровь. Продолжительное разрушение сперматогенных клеток при одновременном повреждении собственной оболочки канальцев способствует возникновению антисеменниковых антител, которые, связываясь с клетками сперматогенного ряда, дополнительно повреждают их.
Аутоиммунные поражения могут сопутствовать многим процессам инфекционного, токсического, ишемического, травматического и другого характера. При длительном или повторяющемся воздействии вредных факторов может наступить аутоиммунный асперматогенез с терминальной аплазией канальцев.
Патогенез и классификация бесплодия. Согласно современным представлениям, для определения характера лечебных мероприятий при мужском бесплодии следует выделять следующие основные формы: секреторную, экскреторную, аутоиммунную, сочетанную и относительную.
Секреторное бесплодие обусловлено гипогонадизмом. Под мужским гипогонадизмом понимают понижение или выпадение гормонпродуцирующей функции гландулоцитов яичка или сперматогенетической функции семенных канальцев, а также одновременное снижение инкреторной и экскреторной функций яичек. Различают первичный и вторичный гипогонадизм.
При первичной функциональной недостаточности яичек патологический процесс поражает непосредственно яички (врожденные дисгенезии, крипторхизм, орхит, травмы). Первичный гипогонадизм сопровождается повышенным выделением гонадотропинов в кровь из-за уменьшения тормозящего влияния яичек на гипофиз, поэтому первичный гипогонадизм принято называть первичным гипергонадотропным гипогонадизмом.
При вторичном гипогонадизме функция яичек страдает в результате поражения определенных отделов ЦНС. Вторичный гипогонадизм, возникающий при различных патологических процессах в гипоталамо-гипофизарной области (травма, нейроинфекция, аденома гипофиза и др.), обусловлен резким снижением секреции гонадотропных гормонов, являющихся мощным специфическим стимулятором функции яичек, поэтому вторичный гипогонадизм носит название вторичного гипогонадотропного гипогонадизма. Среди секреторных форм бесплодия необходимо выделять дискорреляционное бесплодие, которое возникает при эндокринопатиях и бесконтрольном применении гормональных препаратов. Кроме вторичного гипогонадизма церебропитуитарного генеза, выделяют коррелятивную недостаточность яичек, обусловленную заболеваниями других желез внутренней секреции, предстательной железы и семенных пузырьков, различными висцеропатиями в отдельный вид недостаточности семенников. Большинство исследователей относят поражение яичек вследствие заболевания эндокринных желез ко вторичному гипогонадизму. Но при таком патогенезе вторичный гипогонадизм может и не сопровождаться снижением содержания гонадотропинов в крови.
Нарушение сперматогенеза при первичном гипогонадизме начинается с дегенерации цитоплазмы апикального полюса сустентоцитов, что приводит к прекращению дозревания и преждевременному слущиванию незрелых сперматид. В дальнейшем происходят мозаичная атрофия части семенных канальцев, равномерное уменьшение количества клеток всех слоев сперматогенного эпителия.
Гипосперматогенез клинически проявляется различными степенями олигоазооспермии. Если патологическое воздействие продолжается, то наступает остановка сперматогенеза на стадии сперматоцитов или сперматогоний, что соответствует азооспермии. При атрофии сперматогенного эпителия (синдроме сустентоцитов) в эякуляте выявляется аспермия.
Токсические, воспалительные процессы вызывают вакуолизацию и десквамацию глубоких слоев семенных канальцев, их фиброзное перерождение, склероз и атрофию паренхимы яичек. Первичное поражение сперматогенного эпителия сопровождается снижением выработки эстрогеноподобного вещества (ингибина) в сустентоцитах. Выявлена прямая корреляция его содержания в крови с плотностью спермиев в эякуляте. Снятие отрицательной обратной связи приводит к повышению уровня ФСГ пропорционально гистологическим изменениям в половых железах и уменьшению количества спермиев в эякуляте. Повышенный уровень ФСГ, в свою очередь, стимулирует выработку ЛТГ, усиливает синтез эстрогенов в клетках Сертоли и, возможно, ароматизацию андрогенов в эстрогены в других органах. Эстрогены в большом количестве выступают как антиандрогены. Они захватывают андрогенные рецепторы, подавляют выработку ЛГ гипофизом и рилизинг-гормона гипоталамусом. Указанные изменения приводят к относительной и абсолютной гипоандрогении, которая вместе с гиперпролактинемией усугубляет патологию сперматогенеза, снижают выраженность вторичных половых признаков, функцию придаточных половых желез, могут вызывать ослабление либидо, оргазма, импотенцию. Вначале страдают поверхностные, а затем все более глубокие слои сперматогенного эпителия, вплоть до полной его атрофии.
Характерным для первичного гипогонадизма является раннее падение резервных возможностей половых желез - функции как интерстициальных эндокриноцитов (гландулоцитов), так и эпителия канальцев. Тесты стимуляции рилизинг-гормоном и гонадотропином подтверждают снижение или отсутствие реакции тестостерона.
Вторичное нарушение сперматогенной функции канальцев, связанное с недостатком ФСГ, сопровождается падением продукции эстрогенов в клетках Сертоли, что нарушает созревание сперматид. При полном отсутствии ФСГ сперматогенез останавливается на стадии сперматогоний. Изолированное первичное или вторичное снижение функции клеток Лейдига приводит к ухудшению сперматомейоза вплоть до остановки созревания на стадии сперматоцитов.
Экскреторное бесплодие развивается вследствие заболевания или пороков развития мочеиспускательного канала и придаточных половых желез, обструкции семявыносящих протоков, асперматизма. При таких пороках развития, как гипоспадия или эписпадия, эякулят при половом сношении может не попадать в половые пути женщины, что и служит причиной экскреторного бесплодия. При воспалительных заболеваниях мочеиспускательного канала и придаточных половых желез нередко отмечаются нарушение их функции, изменение состава семенной жидкости, накопление в ней продуктов распада и жизнедеятельности микробов, развитие токсических, иммунных процессов, что снижает оплодотворяющую способность спермиев и приводит к бесплодию. Бактерии при воспалении придаточных половых желез - лишь пусковой механизм, далее воспалительный процесс поддерживается аутоагрессией вследствие образования антител к тканям и спермиям. Длительный воспалительный процесс сопровождается повреждением интерорецепторов и проводящих путей, нарушением продукции фруктозы, лимонной кислоты, кислой, щелочной фосфатаз и др. Одновременно выявляется снижение глюкокортикоидной функции надпочечников и инкреторной функции яичек.
Чем тяжелее процесс, тем значительнее гормональные сдвиги. Снижается уровень тестостерона, возрастает содержание гонадотропинов (ФСГ, ЛГ, ЛТГ) и эстрогенов, что приводит к нарушению сперматогенеза.
Воспалительный процесс, травма, врожденная аплазия придатков или семявыносящих протоков могут служить также причиной возникновения экскреторно-обструктивной формы бесплодия.
Односторонняя обтурация семявыносящих путей, как правило, не приводит к бесплодию, так как второе яичко при хорошей проходимости семявыносящих протоков поставляет достаточное количество спермиев. При двусторонней обструкции семявыносящих путей спермин и клетки сперматогенеза не попадают в эякулят, т. е. развивается аспермия. При этом функция желез обычно не нарушается, и сперматогенез сохраняется, если облитерация находится дистальнее тела придатка яичка [Михайличенко В. В., 1983]. Спермии, попавшие в придаток, не могут проникнуть обратно в яичко благодаря наличию тонких клапанов в d. efferentes. Придаток яичка растягивается; в результате долгого стаза спермии погибают, частично распадаются и подвергаются поглощению и перевариванию особыми клетками - спермиофагами. Сперматогенный эпителий может погибнуть лишь в том случае, если нарушено сообщение между яичком и придатком. Облитерация всего придатка яичка, являясь причиной застойного давления в семенных канальцах, ведет к гибели генеративного эпителия и перитубулярному фиброзу. При локализации процесса в хвостовом отделе придатка яичка в последнем сохраняется нормальный сперматогенез. Эти наблюдения подтверждают в эксперименте A. Rost и соавт. (1979). Авторы обнаружили после эпидидимэктомии у крыс распад зародышевых клеток и сперматогенетических канальцев, а также выраженную атрофию интерстиция, в то время как у вазэктомированных животных сперматогенез сохранялся.
Двусторонняя непроходимость семявыводящих путей проявляется аспермией. При нормальном сперматогенезе из-за обтурации семявыводящих протоков спермии и клетки спермиогенеза в эякулят не поступают.
Секреторную аспермию от экскреторной при наличии у больного яичек нормальных размеров можно отличить только путем гистологического исследования биоптата яичка.
Наличие нормальной гистологической картины при аспермии указывает на облитерацию семявыносящих путей (экскреторное бесплодие). Отсутствие сперматогенного эпителия в семенных канальцах подтверждает секреторное происхождение аспермии.
К экскреторному бесплодию большинство исследователей относят также асперматизм (отсутствие семяизвержения при половом акте). Происхождение асперматизма связывают с нарушением функции периферической и центральной нервной системы. Различают истинный асперматизм, при котором половой акт не завершается семяизвержением, а следовательно, и оргазмом, и ложный асперматизм, при котором половой акт заканчивается семяизвержением и оргазмом, но эякулят забрасывается в мочевой пузырь. Ложный асперматизм может наступить в результате нарушения иннервации или атонии внутреннего сфинктера мочевого пузыря после забрюшинной лимфаденомэктомии, после аденомэктомии и др. При истинном асперматизме страдают копулятивная и генеративная функции, тогда как при ложном асперматизме нарушается лишь способность к оплодотворению.
Иммунное бесплодие может быть результатом иммунологического конфликта между супругами, возникающего в ответ на поступление в половые пути женщины эякулята, обладающего мощными антигенными свойствами. Конфликту могут способствовать идиосинкразия, несовместимость по системе АВО, нарушения в состоянии гуморальных и центральных звеньев иммунитета и пр.
Аутоиммунное бесплодие возникает у мужчин при нарушении гематотестикулярного барьера. Аутоиммунные процессы могут сопутствовать инфекционным заболеваниям, орхитам, травмам яичка, варикоцеле, экзогенным интоксикациям и другим патологическим процессам.
Сочетаннная форма бесплодия выделена в 1972 г. И. Ф. Юнда. При этом наблюдается сочетание секреторной недостаточности, обусловленной гормональными нарушениями различного характера, и экскреторного компонента в виде воспалительных изменений в добавочных половых железах. Тщательное обследование пациента позволяет решить вопрос, какой из названных факторов превалирует и с чего начинать лечение.
Относительное бесплодие устанавливается в том случае, когда при обследовании супружеской пары патологических изменений не выявляется. Возможно, это связано с несовершенством методов обследования. При относительном бесплодии нередко обнаруживаются иммунологические причины, нарушение функции ЦНС, сексуальные расстройства у женщин, биологическая неполноценность зародышевых клеток; выявляются и другие нарушения.
Следовательно, термин "относительное бесплодие" должен применяться с большой осторожностью. При установлении диагноза "относительное бесплодие" необходимо тщательно обследовать супругов. Особое значение следует придавать исследованию эякулята, морфологическим и физиологическим особенностям спермиев (резистентность, дыхательная и пенетрационная способность), а также иммунологическим взаимоотношениям супружеской пары. Вполне вероятно, что с появлением новых способов исследования функциональной способности спермиев, более широкого использования иммунологических тестов относительное бесплодие перестанет существовать.
Классификация. Полиэтиологичность, полипатогенетичность мужской инфертильности, функциональная взаимосвязь яичек практически со всеми системами и органами определяют большие трудности при создании классификации мужского бесплодия, которая удовлетворяла бы всех клиницистов.
Приводим классификацию мужской стерильности, которая используется в нашей клинике.
Классификация бесплодия у мужчин
I. Секреторное бесплодие:
- первичная недостаточность яичек (вследствие поражения самих яичек врожденного и приобретенного генеза);
- вторичная недостаточность яичек:
- центрального происхождения (вследствие поражения гипоталамо-гипофизарной области и других отделов ЦНС);
- дискорреляционная недостаточность яичек (вследствие нарушения функции эндокринных желез и других внутренних органов).
II. Экскреторное бесплодие:
- заболевания и пороки развития мочеиспускательного канала и придаточных половых желез;
- экскреторно-обтурационное бесплодие (вследствие врожденной и приобретенной обструкции семявыносящих путей);
- асперматизм.
III. Иммунное бесплодие.
IV. Сочетанное бесплодие (секреторная недостаточность половых желез в сочетании с воспалительными, обструктивными и иммунными процессами).
V. Относительное бесплодие (при отсутствии, несмотря на тщательное обследование супругов, причин, вызывающих бесплодие).
Современные успехи в морфологии, эндокринологии, биохимии, иммунологии, медицинской генетике и в урологии позволили разработать ряд новых эффективных диагностических методов, повышающих возможности клиницистов в распознавании нарушений репродуктивной функции у мужчин.
Диагностика бесплодия. Брак следует считать бесплодным, если беременность не наступает в течение года нормальной жизни без применения противозачаточных средств. Такую супружескую пару необходимо направить на обследование в консультативно-диагностический центр "Брак и семья". Там, где они отсутствуют, женщина проходит обследование в женской консультации, мужчину направляют в урологическое отделение поликлиники. Минимальное обследование женщины должно заключаться в определении регулярности овуляции и проходимости маточных труб.
Диагностика бесплодия у мужчин должна включать анамнез, общее обследование больного, объективное исследование половых органов, анализ эякулята, исследование эндокринной функции яичек, надпочечников, гипоталамо-гипофизарной системы, биопсию яичек, генитографию.
Анамнез. Сбору анамнеза при бесплодии должно придаваться особое значение, так как он позволяет получить представление о больном и осветить различные стороны этиологии заболевания. Обращается внимание на возраст и профессию больного. С увеличением возраста наблюдается ослабление способности к оплодотворению. Из профессиональных вредностей, отрицательно влияющих на фертильность, следует отметить гипертермию, ионизирующее и другие виды излучения, анилиновые красители, промышленные яды, алиментарный фактор и т. д. Выясняют наличие хронических интоксикаций, злоупотребления алкоголем, никотином, прием лекарственных препаратов (гормонов, наркотиков, нитрофуранов, сульфаниламидных препаратов, неомицина). Необходимо выяснить наследственные болезни, эндокринные нарушения, повреждения головного мозга, психические травмы, перенесенные заболевания (туберкулез, сыпной тиф и брюшной, паротит, заболевания почек и печени, венерические болезни), травмы половых органов. Особое внимание уделяют заболеваниям половых органов (простатит, везикулит, уретрит, колликулит, эпидидимит), которые отрицательно влияют на генеративную и копулятивную функции. Отмечают состояния, способствующие развитию застойных явлений в органах малого таза (сидячий образ жизни, венная болезнь). Следует установить, были ли операции на половых органах, а также по поводу паховой грыжи, варикоцеле. Обращают внимание на половое развитие пациента (возраст при первом половом сношении; выраженность либидо, характер эрекции, оргазма, частота половых сношений, их длительность). Важно установить длительность брака, который не сопровождался беременностью жены, наличие детей, родились ли они до заболевания или после него, использование противозачаточных средств.
Общее обследование. При общем осмотре больного оценивают физическое развитие, пропорциональность телосложения, распределение подкожной жировой клетчатки, волосяного покрова, характер оволосения половых органов, состояние скелетно-мышечной системы, состояние кожи, мышечный тонус.
При дефиците тестостерона наблюдаются слабое развитие мускулатуры, низкая работоспособность, быстрая утомляемость, бессонница, ослабление роста бороды и усов, депрессивное состояние и нарушение половой потенции. Кожа у таких больных нежна и бледна. Холодные руки и ноги указывают на вегетативную лабильность.
Для выявления отклонений от нормального морфотипа целесообразно провести антропометрическое обследование больного по методике Декура Думика. Она основана на определении 5 величин: окружность грудной клетки, высота ноги, рост, ширина таза, ширина плеч. Согласно теоретическим предположениям, лежащим в основе антропометрии, функция половых желез и надпочечников оказывает решающее влияние на половую дифференцировку формы тела. Недостаточность андрогенов в пубертатном периоде задерживает окостенение эпифизарных хрящей, вследствие чего длина конечностей становится преобладающей над длиной туловища. Изменяется также соотношение между шириной плеч и таза. В норме у мужчины разница между шириной плеч (расстояние между наиболее выступающими участками дельтовидных мышц) и таза (distantia trochanterica) равна 10-12 см. Важное значение при антропометрии имеет трохантерный индекс: отношение роста к длине ноги (расстояние от верхнего края большого вертела до основания, на котором стоит обследуемый), - равный в норме 1,93-1,97. Трохантерный индекс менее 1,92 и разница между шириной плеч и таза менее 9 см в сравнении со здоровыми мужчинами указывают на дефицит андрогенов в организме.
Обследование половых органов заключается в осмотре полового члена и мошонки, исследовании предстательной железы и семенных пузырьков. При осмотре полового члена выявляются пороки развития (гипоспадия, эписпадия), состояние крайней плоти и наружного отверстия мочеиспускательного канала, наличие уплотнений в пещеристых телах. При обследовании мошонки обращают внимание на ее размеры, степень отвисания, выраженность или отсутствие складчатости и пигментации, указывающие на недостаток андрогенов в организме. Затем определяют положение яичек в мошонке и их придатков, их размеры, консистенцию. Нормальные размеры яичек: длина 4-5 см, толщина 2,5-3 см. Продольный размер яичек менее 3 см свидетельствует о их гипоплазии. Мягкие, вялые, нечувствительные яички указывают на нарушение их функции. Напряженные, эластические яички являются хорошим признаком сперматогенеза. Внимательно производится пальпация придатка яичка. При отсутствии головки, тела, хвоста придатка яичка можно обнаружить фиброзный тяж или кисту, что указывает на порок его развития. При перенесенном воспалении часто обнаруживаются утолщение и уплотнение придатка яичка. Обнаружение при пальпации растянутой, увеличенной головки придатка указывает на наличие обтурации дистальнее головки. При пальпации семенного канатика исследуют толщину и гладкость семявыносящих протоков, а также наличие или отсутствие извитых расширенных вен. Нередко при пальпации органов мошонки можно определить варикоцеле, гидроцеле, пахово-мошоночную грыжу, кисты придатков, которые могут оказывать отрицательное влияние на течение сперматогенеза. Затем переходят к исследованию предстательной железы и семенных пузырьков.
Исследование эякулята. Решающее значение для диагностики функциональных нарушений половых желез и суждения о плодовитости мужчин имеют макроскопические, микроскопические, биохимические и иммунологические исследования эякулята. Методы получения эякулята почти всеми исследователями унифицированы. Чаще всего эякулят получают путем мастурбации, реже прерванным половым сношением или раздражением спинального эякуляторного центра с помощью введенных в прямую кишку электродов. Используется также вибромассаж полового члена.
Рекомендуется исследовать эякулят после 4-5-дневого воздержания. Эякулят должен быть получен полностью, так как различные его порции содержат неодинаковое количество спермиев. Приступать к микроскопическому исследованию следует через 30-40 мин после получения эякулята, так как в течение этого времени происходит его разжижение. При повышении температуры жизненные процессы спермиев усиливаются, и небольшой запас собственной энергии быстро истощается. Постепенное охлаждение эякулята тормозит метаболизм спермиев, резкое - может вызвать холодовой шок. Шок парализует дыхание, ведет к торможению фруктолиза, и спермии становятся неподвижными. В таком случае согревание или добавление теплого 5% раствора глюкозы может привести к восстановлению их подвижности. При сомнительных результатах необходимо производить повторные исследования эякулята.
Макроскопическое исследование эякулята сводится к определению объема, вязкости, запаха, цвета, рН.
Объем. Количество эякулята в норме находится в пределах 2-5 мл, но бывают значительные колебания. Объем эякулята менее 1 мл характерен для андрогенной недостаточности. В таком случае можно также думать о сужении и деформации семенных пузырьков и семявыносящих путей. Среднее количество эякулята у здоровых мужчин должно быть, по нашим данным, 3,7 мл. Избыточное количество эякулята (более 7-8 мл) обычно сопровождается уменьшением концентрации спермиев.
Запах. Спермин, вырабатываемый предстательной железой, придает свежему эякуляту характерный запах, напоминающий запах цветов каштана. Отсутствие характерного запаха указывает на отсутствие секрета предстательной железы. При длительном хранении в обычных условиях в эякуляте быстро развивается микрофлора и появляется гнилостный запах.
Цвет. При большом количестве спермиев цвет эякулята молочный, опалесцирующий в проходящем свете, при малом же количестве - прозрачно-голубоватый. При азооспермии эякулят, как правило, бывает прозрачным. Примесь более или менее значительного количества лейкоцитов (пиоспермия) придает эякуляту гнойный вид, а эритроцитов (гематоспермия) - красноватый вид, что указывает на патологический процесс в предстательной железе или семенных пузырьках.
Вязкость. Сразу же после эякуляции начинается процесс свертывания, а затем в течение 10-30 мин идет процесс разжижения. Чтобы не ошибиться в определении числа и оценки подвижности спермиев, следует выждать полного разжижения эякулята. Определение вязкости имеет большое значение при уменьшении подвижности спермиев. Считают, что повышенная вязкость эякулята и наличие в нем слизи снижают скорость движения спермиев. Степень вязкости определяют длиной нити, образующейся между поверхностью эякулята и стеклянной палочкой, удаляемой из него. Вместо стеклянной палочки можно пользоваться фильтровальной бумагой. Нормальной считается вязкость при длине нити 0,1-0,5 см. При воспалительных заболеваниях предстательной железы и семявыносящих путей количество слизи и вязкость эякулята могут возрастать.
рН эякулята. рН свежего эякулята составляет в среднем 7,3-7,7. Щелочная реакция обеспечивает нормальную подвижность спермиев, позволяет им быстро миновать неблагоприятную среду влагалища с кислой средой (рН 4,0-4,2) и достигнуть шейки матки, секрет которой имеет рН 7,5. Реакция эякулята вариабельна у разных мужчин, но у одного и того же пациента относительно постоянна. рН эякулята определяют с помощью индикаторной бумаги или рН-метра. Индикатором для определения рН эякулята может служить 0,1% спиртовый раствор нейтрального красного (2 объема) +0,1% спиртовой раствор метиленового синего (1 объем).
Каплю эякулята смешивают с каплей индикатора и по цветной реакции судят о рН: 6,2 - интенсивно-фиолетовый; 6,4 - фиолетовый; 6,6 - светло-фиолетовый; 6,8 - серо-фиолетовый; 7,0 - темно-серый; 7,2 - серый; 7,4 - серо-зеленый; 7,6 - светло-зеленый; 7,8 - зеленый. По нашим данным, рН эякулята у здоровых мужчин колеблется в пределах 7,6-7,8.
Микроскопическое исследование эякулята. Для микроскопического исследования эякулята пользуются обычным микроскопом с увеличением от 120 (объектив 8, окуляр 15) до 400 (объектив 40, окуляр 10) или люминесцентным микроскопом ЛЮМАМ-И-2. Исследование производят при комнатной температуре (не ниже +20 °С).
Для обзорной микроскопии используют нативный препарат, который готовят из свежего эякулята следующим образом. На чистое предметное стекло после перемешивания в стаканчике пипеткой наносят каплю исследуемой спермы и покрывают покровным стеклом. Обзорная микроскопия позволяет получить первое впечатление о количестве, качестве и подвижности спермиев.
При просмотре нативных препаратов оценивается агглютинация спермиев - склеивание друг с другом в отдельные конгломераты, величины которых зависят от степени выраженности агглютинации. При слабой степени агглютинации (+) склеены только единичные спермии; при средней (2+) - склеены около половины спермиев лишь головками; при сильной агглютинации (3+) около половины спермиев склеены как головками, так и хвостами. Агглютинация, обозначенная (4+) - массовая, склеены почти все спермии. Агглютинация спермиев может наблюдаться при воспалительных заболеваниях половой сферы, сопровождающихся изменениями рН, накоплением молочной кислоты, при аугоиммунизации организма антигенами тестикулярного происхождения. При отсутствии спермиев следует исследовать осадок после его центрифугирования. Для обнаружения в эякуляте клеток сперматогенеза и окончательного заключения рекомендуется исследовать окрашенный препарат. Мазок готовят следующим образом. На обезжиренные стекла, обработанные смесью Никифорова, наносят каплю плазмы крови, тщательно растирают и стекла сушат в течение суток под стеклянным колпаком для предохранения от пыли, где и хранят. При необходимости на такое стекло наносят каплю эякулята и размазывают, как мазок крови. Высушенный в течение суток мазок фиксируют в метаноле 2 мин. Мазок снова высушивают и красят 8-10 мин краской Романовского (5 мл краски Романовского на 100 мл дистиллированной воды). Препарат осторожно промывают водой, сушат и исследуют с помощью иммерсионной системы. Кроме патологических и нормальных спермиев, обнаруживаются клеточные и неклеточные элементы. Часто встречаются делящиеся клетки. Незрелые половые клетки имеют округлую форму, размеры их варьируют в зависимости от степени зрелости (рис. 74).
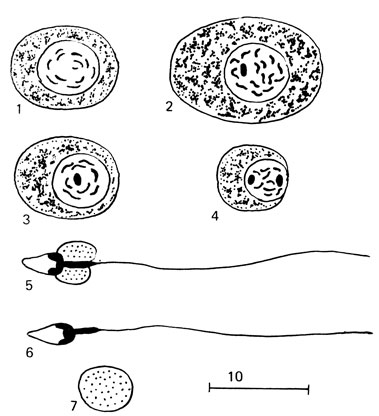
Рис. 74. Клетки сперматогенеза. 1 - сперматогония; 2 - сперматоцит; 3 - пресперматида; 4 - сперматида; 5 - сперматозоон с цитоллазматической каплей; 6 - спермин; 7 - цитоплазматическая капля
Сперматогонии - интенсивно окрашенные, сравнительно мелкие (5-12 мкм), правильной округлой формы клетки с относительно крупными ядрами, имеющими четкие очертания и равномерно зернистую структуру. Цитоплазма базофильная, окружает ядро узким ободком.
Сперматоциты - клетки более светлые, больших размеров (до 17-19 мкм в диаметре), с крупными ядрами и неравномерно расположенными в них хроматиновыми нитями. Слабобазофильная цитоплазма в виде узкого ободка располагается вокруг ядра. Размеры этих клеток и структура ядра меняются по мере созревания.
Сперматиды - самые мелкие клетки сперматогенного эпителия. Сперматиды созревают в спермии. Морфология их меняется в зависимости от степени зрелости. Ядра расположены у незрелой сперматиды центрально, затем - эксцентрично, цитоплазма бледно-базофильная. В процессе созревания сперматиды и выхода спермиев в эякуляте появляются безъядерные формы (резидуальные тела).
Гигантские клетки, как правило, обнаруживаются в эякуляте, содержащем большое количество клеток сперматогенеза. Они возникают из сперматид, если делению подвергаются только ядра без плазмы.
Такие клетки имеют размеры 20-22 мкм и могут содержать от 2 до 22 ядер (рис. 75).
Спермиофаги - крупные, округлой формы клетки до 20-36 мкм в диаметре, содержащие одно или несколько ядер со светлой, часто вакуолизированной цитоплазмой. В цитоплазме часто можно рассмотреть головки фагоцитированных сперматозоидов. Спермиофаги появляются при длительном половом воздержании или обтурации семявыносящих путей.
Лейкоциты - в нормальной сперме обнаруживаются единичные клетки. При воспалительных заболеваниях придаточных половых желез и семявыводящих путей количество лейкоцитов увеличивается и могут появляться эритроциты. Мы производили подсчет числа лейкоцитов в камере Горяева одновременно с подсчетом спермиев. При этом лейкоциты исчисляются миллионами в 1 мл эякулята. При нормоспермии, по нашим данным, содержится от 1 до 10 млн лейкоцитов, в среднем (3,5 ±0,5)·106 в 1 мл спермы.
Эпителиальные клетки. В нормальном эякуляте обнаруживается в небольшом количестве призматический эпителий мочеиспускательного канала. При патологических процессах в уретре в сперму могут попадать клетки многослойного эпителия с ороговением из ладьевидной ямки мочеиспускательного канала. При отсутствии обтурации семявыносящего протока в эякуляте могут определяться единичные полигональные формы клеток эпителия придатка яичка диаметром or 18 до 42 мкм, с крупным ядром и обширной цитоплазмой. Реже в патологических эякулятах появляются эпителиальные клетки Сертоли (опорные клетки). Они имеют крупные размеры (от 20 до 40 мкм), светлое ядро угловатой формы. В их цитоплазме определяются многочисленные включения (жировые, липоидные, белковые кристаллы).
Липоидные тельца - мелкие, блестящие зерна - являются продуктом секреции предстательной железы. В нормальном эякуляте они содержатся в значительном количестве и придают ему опалесцирующий вид из-за сильного преломления света. При воспалительном процессе в предстательной железе наблюдается уменьшение числа липоидных телец с увеличением числа лейкоцитов.
Семенные кристаллы Бетхера бесцветные, удлиненной или звездчатой формы, образуются в охлажденной сперме из спермина и фосфата. При аспермии их количество увеличивается.
Амилоидные тельца имеют овальную форму и характерное слоистое строение, напоминающее косой спил дерева. В норме не встречаются. Появляются при застое в предстательной железе.
Подвижность спермиев. Подвижности спермиев придается очень большое значение при оценке качества эякулята. Вероятность оплодотворения снижается с уменьшением количества хорошо подвижных спермиев в эякуляте. Наличие слизи затрудняет движение спермиев. Большое значение для движения спермиев имеет присущий им отрицательный электрический заряд, благодаря чему не происходит столкновения и слипания спермиев в густом эякуляте. Сдвиг рН в кислую сторону снижает электрический заряд спермиев и вызывает их агглютинацию. Агглютинация может быть также признаком аутоиммунных реакций в организме больного.
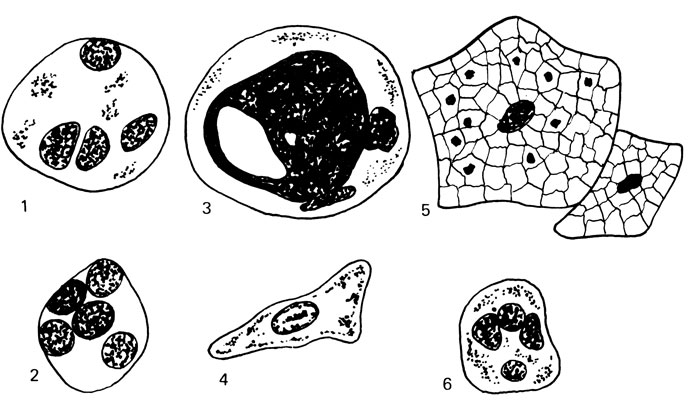
Рис. 75. Добавочные клетки эякулята. 1 - макрофаг; 2 - микрофаг; 3 - спермиофаг; 4 - клетки Сертоли; 5 - клетки эпителия; 6 - лейкоцит
Различают следующие виды движения спермиев в эякуляте: 1) прямолинейное поступательное движение со спиральным вращением вокруг своей оси; 2) манежное, или так называемое круговое прогрессивное, движение, при этом движении спермии вращаются вокруг своей головки или по небольшому кругу; 3) колебательное, местное движение, когда имеется движение хвоста, но не происходит перемещения спермиев.
Прогрессивно-поступательное движение со спиральным вращением вокруг своей оси характеризует нормальные здоровые спермии. Многие авторы считают, что при нормоспермии должно быть 75-80% подвижных форм. Можно допустить не более 30% неподвижных форм.
Оценка подвижности спермиев производится по общепринятой 5-балльной системе: отсутствие - 0; плохая - 1; средняя - 2; хорошая - 3; отличная - 4. Е. Молнар (1969) оценивает подвижность также по 5-балльной системе: 0 - отсутствие движения; 1 - дергающиеся на месте спермии; 2 - вялое, почти не прогрессирующее; 3 - слабопрогрессирующее движение; 4 - очень быстрое целесообразное движение.
В норме подвижность 70-80% спермиев должна соответствовать оценкам 3-4. Чем продолжительнее жизнь спермия (в норме 18-20 ч), тем выше их способность к оплодотворению. Для установления продолжительности движения спермиев и индекса их выживаемости определяют количество подвижных спермиев через 3 ч, 6 ч и более. У здоровых мужчин с нормальным сперматогенезом в среднем число двигающихся спермиев уменьшается через 3 ч на 7%, через 6 ч - на 15%, а через 24 ч - только 10% сперматозоидов продолжает двигаться у каждого второго мужчины. Чем глубже поражение сперматогенеза, тем меньше длительность движения спермиев.
Для определения общего числа спермиев и процента подвижных форм эякулят разбавляют в смесителе для лейкоцитов либо в растворе Рингера или Бекера, либо в 5% растворе глюкозы из расчета 1:20. При малом количестве спермиев эякулят можно развести из расчета 1:10, смеситель с эякулятом встряхивают, первую каплю выпускают, а затем заполняют любую счетную камеру для подсчета форменных элементов крови - Бюркера, Ключарева - Предтеченского, Горяева, Тома, Нейбауэра и др. Подсчет производят в пяти больших или 80 малых квадратах. В таком случае определение количества спермиев в эякуляте (аналогично подсчету лейкоцитов в крови) можно вычислить по единой для всех счетных камер формуле:
| Х | а=х40000х1000хв | . |
| б |
где X - количество спермиев в 1 см3; а - количество спермиев в определенном объеме камеры; б - количество сосчитанных маленьких квадратов; в - разведение эякулята.
Чтобы легче производить подсчет количества спермиев в 1 см3, а затем во всем эякуляте, следует разбавлять его в смесителе 1% жидкостью Дакена, разведенной уксусной или хлористоводородной кислотой, 2% раствором гидрата окиси натрия, 3% раствором натрия хлорида, 1% раствором формалина и другими растворами или красителями, которые убивают спермиев.
Для простоты пересчета следует помнить, что найденное количество спермиев в 5 больших квадратах сетки Горяева нужно умножить на 1000000. Это число будет соответствовать количеству спермиев в 1 мл эякулята. Общее количество спермиев в эякуляте будет равно количеству спермиев в 1 мл, умноженному на весь объем полученного эякулята в миллилитрах.
Для определения процента подвижных форм следует развести эякулят изотоническим раствором натрия хлорида, заполнить описанным способом камеру Горяева и считать только неподвижные спермии в 5 больших квадратах. Тогда количество подвижных спермиев будет равно общему количеству спермиев минус количество неподвижных спермиев. Ответ дается в процентах.
Большинство авторов считают, что 60-50 млн спермиев в 1 мл эякулята являются нижней границей нормы, за которой отмечается переход в олигоспермию (3 степени).
Олигозооспермия I степени (от 60· 109/л до 30·109/л спермиев) - легкая степень олигозооспермии со сниженной способностью к оплодотворению.
Олигозооспермия II степени (от 29·109/л до 10·109/л спермиев) - средняя степень олигозооспермии со значительным снижением способности к оплодотворению.
Олигозооспермия III степени (ниже 10·109/л спермиев) - очень тяжелая степень бесплодия.
Полизооспермия характеризуется наличием в 1 мл эякулята свыше 200 млн спермиев. Повышенная сперматогенетическая активность семенных канальцев яичек приводит к появлению спермиев с низкой оплодотворяющей способностью.
Некроспермия - состояние, при котором в эякуляте обнаруживаются только мертвые спермии и они не могут быть оживлены.
При полном отсутствии в эякуляте спермиев выделяют 2 состояния: 1) азооспермия, при которой в эякуляте отсутствуют спермии, но обнаруживаются клетки сперматогенеза; 2) аспермия, при которой в эякуляте отсутствуют и спермии, и клетки сперматогенеза.
Азооспермия характерна для секреторной формы бесплодия, при которой имеется угнетение сперматогенеза на различных стадиях. Это подтверждается нахождением в эякуляте тех или иных клеток сперматогенеза.
Аспермия характерна для экскреторной формы бесплодия и связана с двусторонней обтурацией семявыносящих протоков при нормальной генеративной функции яичек. Однако аспермия может указывать и на полное отсутствие сперматогенного эпителия. Для установления истинной причины патоспермии в таких случаях показана биопсия яичка.
Тератозооспермия характеризуется большим количеством дегенеративных форм спермиев (свыше 30%).
Астенозооспермия - довольно частое патологическое состояние, при ней наблюдается лишь нарушение подвижности спермиев. Количество малоподвижных или неподвижных форм превышает 30%.
Асперматизм - отсутствие выделения эякулята при половом акте. При истинном асперматизме (анэякуляторном синдроме) половой акт не заканчивается семяизвержением, а следовательно, и оргазмом. При ложном асперматизме половой акт заканчивается семяизвержением и оргазмом, но эякулят забрасывается в мочевой пузырь.
При отсутствии эякулята после полового акта у больных следует исследовать осадок мочи, в котором могут быть обнаружены спермии вследствие заброса эякулята в мочевой пузырь. Анамнез, а также исследование мочи после полового акта помогают дифференцировать указанные формы асперматизма.
Морфологическое исследование эякулята производят при 400-кратном и большем увеличении. Маленькую каплю убитых спермиев из смесителя для лейкоцитов наносят на чистое предметное стекло и покрывают покровным стеклом. Производят подсчет процента морфологически измененных форм. Можно исследовать окрашенные препараты. Для суправитальной окраски нужно добавить к эякуляту 1% водный фильтрат бриллиантового крезилового голубого. При осмотре препарата обращают внимание на изменения головки, шейки, хвоста. Морфограмма эякулята состоит из сперматограммы и цитограммы. В сперматограмме должны быть указаны варианты найденных патологических форм спермиев: формы с чрезвычайно маленькой и необыкновенно большой головкой, переполненные или бедные хроматином; формы с обратным положением хроматина в головке с разбухшей или удвоенной головкой, с изгибом и девиацией шейки, с удвоенными хвостами (рис. 76). Внутри этой группы имеются физиологические вариации: юные формы с фрагментами цитоплазмы, которые малое время находились в придатке яичка, где происходит их дозревание и старые перезрелые формы, в головках которых обнаруживаются вакуоли.
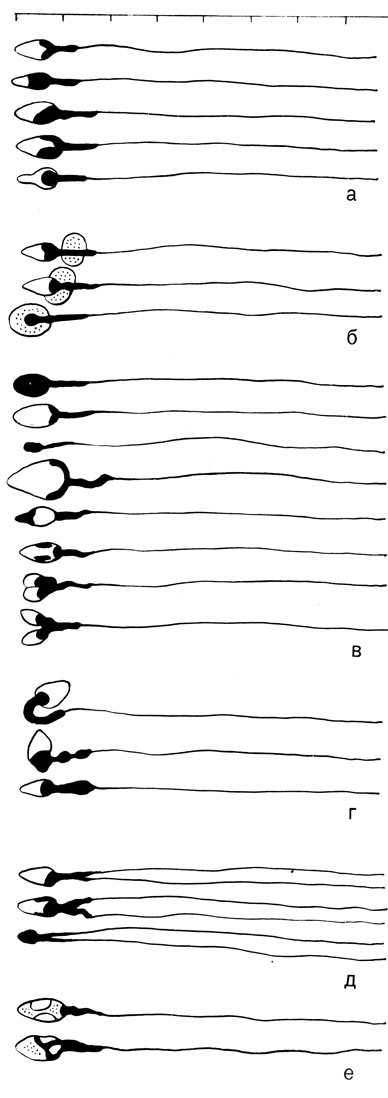
Рис. 76. Схематическое изображение нормальных и патологических форм спермиев. а - нормальные варианты спермиев; б - юные формы; в - изменения головки; г - изменения шейки; д - изменения хвоста; е - старые формы
При нормозооспермии, по данным нашей клиники, встречается от 5 до 24% (в среднем 9%) морфологически измененных форм. Для окончательного заключения необходимо высчитать статистический коэффициент вариации, который определяется биометрией 500 головок спермиев.
В цитограмме должны быть указаны клетки сперматогенеза (сперматоциты, сперматиды, сперматогонии, клетки Сертоли) и другие клеточные элементы (эпителиальные клетки, лейкоциты, эритроциты и др.). Клеток сперматогенеза в норме должно быть не более 10%. При патологических состояниях они вовсе отсутствуют или количество их резко возрастает. Юных форм должно быть не более 2%, старых до 4%. При патологических изменениях в семявыносящих путях могут определяться эритроциты, значительное количество лейкоцитов, а также микробы и простейшие (трихомонады и др.). Лейкоциты в большом количестве выявляются в эякуляте мужчин, страдающих олигозооспермией, что может указывать на наличие воспалительного процесса в половых органах.
Ценными методами определения морфологических свойств спермиев являются фазовоконтрастная, а также люминесцентная и электронная микроскопия. Однако эти методы могут дополнить данные обычной микроскопии.
Определение резистентности спермиев. Установление продолжительности движения спермиев через 3-6-24 ч, о котором говорилось выше, - это определение устойчивости спермиев по отношению ко времени. Некоторые авторы определяют резистентность спермиев по отношению к растворам с различными рН (щелочи и кислоты), а также к гипер- и гипотоническим растворам. Определение резистентности спермиев к 1% раствору натрия хлорида проводят двумя способами: либо по В. К. Милованову, либо ускоренным, по А. И. Короткову. Сперму разводят в 500, 1000, 2000, 4000, 6000, 8000 и т. д. раз. После каждого разведения исследуют подвижность спермиев. При этом способе их устойчивость выражается степенью разбавления 1% раствором натрия хлорида, при котором прекращается движение спермиев.
Понижение резистентности указывает на неполную зрелость спермиев, которую может обусловить дисфункция придатка яичка. По мере прохождения через придаток яичка резистентность спермиев обычно увеличивается за счет их созревания. Уменьшение резистентности указывает на наличие патологических изменений прежде всего в этом отделе полового тракта. По данным нашей клиники, резистентность спермиев в норме равна 8000-14000 (в среднем 12000).
Оценка дыхательной способности спермиев. Интенсивность дыхания спермиев можно определить по времени обесцвечивания метиленового синего (метод Н. П. Шергина), которое наступает по исчерпании в сперме всего растворенного кислорода. На предметное стекло наносят каплю 0,01% раствора метиленового синего и добавляют каплю свежеполученного эякулята. Обе капли смешивают трубочкой с внутренним диаметром 1 мм и насасывают в нее смесь. Высота окрашенного столбика смеси должна быть 2 см. Трубку кладут на белую бумагу и отмечают время обесцвечивания метиленового синего, которое зависит от концентрации, подвижности спермиев. По скорости обесцвечивания судят об интенсивности дыхания спермиев. При нормозооспермии интенсивное дыхание протекает в течение 23-75 мин, в среднем 47 мин.
Метод унифицирован В. Д. Неробеевым (1979).
Электроспермография. Вязкость и время разжижения спермы являются одними из критериев ее нормального или патологического состояния; эти показатели зависят в основном от активности протеолитических ферментов мужского полового тракта. Клинически важны как повышение, так и снижение вязкости спермы, так как при этом изменяется способность спермиев к внедрению из спермы, что препятствует зачатию. Нарушения вязкости эякулята могут быть обусловлены разными воспалительными процессами в мужских половых органах, алкоголизмом, ферментопатиями, муковисцидозом или могут быть идиопатическими.
Для повышения точности и достоверности определения качества спермы по ее вязкости и времени разжижения В. В. Михайличенко (1983) предложил способ, отличающийся тем, что сперму исследуют в воздушном термостате коагулографа Н-333 при температуре (+37±0,5) °С и получают электрографическое изображение процесса разжижения спермы. На полученной диаграмме измеряют наименьшую и наибольшую амплитуду колебания, а также расстояние между ними, на основании этого судят о вязкости и времени разжижения. Этот метод исследования процесса разжижения спермы назван электроспермографией.
Нормальная электроспермограмма (рис. 77) характеризуется следующими показателями: Т0 - время, прошедшее от момента получения эякулята до начала записи (определяется по секундомеру); T1(TAB) - время, прошедшее от начала записи до появления первого колебания на графике (соответствует фазе коагуляции эякулята), равное в норме 4 мин 18 с±10 с; Т2(ТВс) - время, прошедшее от первого колебания на графике до появления максимальной амплитуды (соответствует фазе разжижения эякулята), равное в норме 5 мин 50 с ±10 с; Т=Т0+ТАС - состоит из фазы коагуляции и фазы разжижения, что, как правило, соответствует времени разжижения эякулята, в норме 10 мин 08 с+10 с.
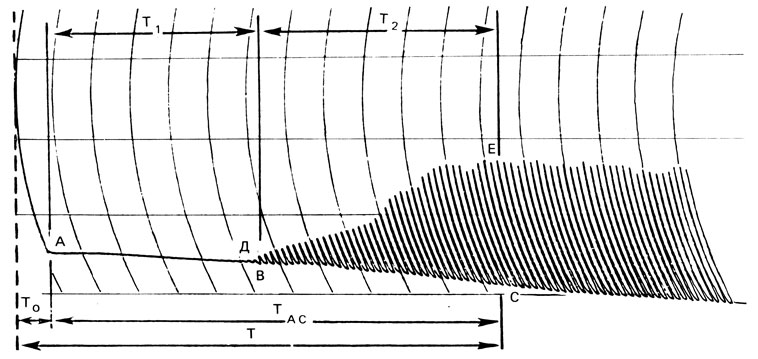
Рис. 77. Нормальная электроспермограмма
Амин (дуга BD) - минимальная амплитуда колебания на диаграмме, характеризует плотность сгустка спермы (в норме соответствует 0,02±0,001 усл. ед.). Амакс (дуга СЕ) - максимальная амплитуда колебания на диаграмме, характеризует вязкость спермы после ее разжижения (равно в норме 3,0±0,2 усл. ед.).
Кривая АДЕ характеризует процесс разжижения спермы. Она может быть пологой и крутой - в зависимости от скорости разжижения, т. е. активности протеолитических и коагулирующих ферментов.
Скорость движения ленты 600 мм/ч; время между двумя импульсами 10 с. Амплитуду колебаний измеряют с помощью шкальной линейки в делениях, и она является показателем вязкости спермы. Исследования О. Л. Тиктинского, В. В. Михайличенко (1982), В. В. Михайличенко (1983) показали: на электроспермограмме объективно отражаются во времени фаза коагуляции и фаза разжижения эякулята, скрытые ранее от глаз исследователя, что дает возможность точно регистрировать начало и конец фазы разжижения. В табл. 4 представлены данные 32 нормальных и 217 патологических электроспермограмм, полученных от больных олигоспермией, азооспермией и аспермией.
Способ прост, позволяет диагностировать бесплодие у мужчин, связанное с нарушением физических свойств спермы (вязкости и времени разжижения), и осуществлять контроль за лечением больных с подобными нарушениями.
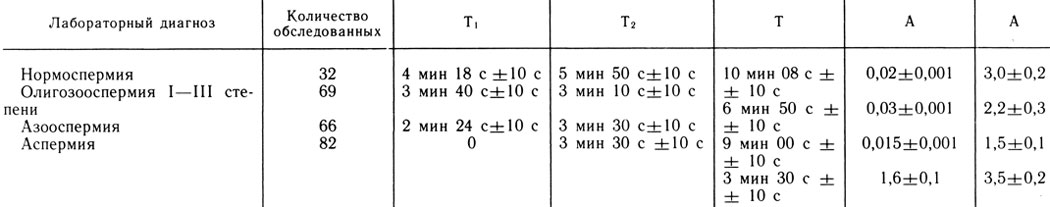
Таблица 4. Показатели электроспермограмм
Биохимические методы исследования эякулята. Изучение биохимического состава эякулята, наряду с исследованием его физиологических и морфологических свойств, является важным для понимания вопросов, связанных с физиологией и патологией сперматогенеза. В состав семенной жидкости человека входит большое количество неорганических и органических элементов (углеводов, липидов, белков, свободных аминокислот, гормонов, витаминов, ферментов). От содержания этих компонентов в определенной мере зависит оплодотворяющая способность спермиев. Однако до настоящего времени биохимический состав спермы и происходящие в ней процессы изучены недостаточно. Наибольшее практическое значение имеет определение фруктозы, фруктолиза и лимонной кислоты в эякуляте.
Определение фруктозы и фруктолиза. Образование фруктозы происходит в семенных пузырьках. За счет расщепления фруктозы (фруктолиза) получается энергия, необходимая для жизненных процессов спермиев. Фруктоза образуется только при достаточной гормональной функции клеток Лейдига. Потребление фруктозы зависит от числа спермиев, их подвижности и способности к фруктолизу. Средняя концентрация фруктозы в эякуляте равна или превышает 14 ммоль/л. Значительное понижение содержания фруктозы (менее 7 ммоль/л) указывает на недостаток андрогенов.
Ход определения. 0,5 мл спермы тщательно смешивают с 7,5 мл дистиллированной воды, затем при помешивании прибавляют 1 мл 10% раствора цинка сульфата и 1 мл 0,5 н. раствора едкого натра. Пробирку на 1 мин погружают в кипящую водяную баню для лучшей коагуляции белка, затем фильтруют. К 2 мл фильтрата прибавляют 2 мл 0,1% спиртового раствора резорцина и 6 мл 30% соляной кислоты. Ставят на 8 мин в водяную баню при температуре + 80 °С. Наступает стойкое окрашивание. Экстинцию исследуемого раствора определяют в фотокалориметре при длине волны 520 нм в сравнении с контрольной пробой, которая вместо спермы содержит 0,5 мл дистиллированной воды. Количество фруктозы определяют по калибровочной кривой, составленной на основании анализа кристаллической фруктозы [Бокуняева Н. И., 1975].
Для определения фруктолиза производят повторное исследование через 2 ч по указанной выше методике. Разница между первым и вторым исследованиями показывает величину фруктолиза.
Лимонная кислота образуется в предстательной железе. В норме концентрация лимонной кислоты в семенной жидкости может служить своеобразным "андрологическим эквивалентом" эндокринной функции яичек. Концентрация лимонной кислоты в эякуляте служит также показателем функционального состояния предстательной железы. В норме концентрация лимонной кислоты в семенной жидкости колеблется от 20 до 30 ммоль/л. При простатите концентрация лимонной кислоты может значительно уменьшаться.
Ход определения. Определение лимонной кислоты начинают с осаждения белков. В колбочке на 25-50 мл или в широкой сахарной пробирке к 0,4 мл эякулята добавляют 7,6 мл дистиллированной воды и 4 мл 60% трихлоруксусной кислоты, встряхивают в течение 10 мин. При необходимости колбочку с содержимым можно оставить при комнатной температуре до следующего дня. Смесь фильтруют. Фильтрат должен быть прозрачным. К 3 мл фильтрата добавляют 1 мл 15 н. раствора серной кислоты; 0,8 мл 0,3 М калия перманганата; 0,2 мл 1 М калия бромида, тщательно перемешивают и оставляют на 15 мин в вытяжном шкафу. Затем избыток калия перманганата удаляют прибавлением 0,5 мл 1,5 М натрия нитрата и в полученную бесцветную жидкость для освобождения от избытка натрия нитрата доливают 0,5 мл 2 М раствора мочевины. Обесцвеченные пробы переводят в делительные воронки. Туда же вливают 10 мл петролейного эфира или гексана. При встряхивании в течение 1 мин экстрагируют пентабром-ацетон - продукт окисления лимонной кислоты. Нижний слой сливают и также при встряхивании реакционную смесь промывают 5 и 3 мл дистиллированной воды. В промытый петролейный эфир добавляют 5 мл реактива из натрия сульфида в этиленгликоле. После добавления реактива жидкость встряхивают еще в течение 1 мин. Через 10 мин окрашенную жидкость сливают и определяют оптическую плотность на ФЭК, используя светофильтр с длиной волны пропускания около 430 нм. Расчет производят по калибровочной кривой. Для ее построения из стандартного раствора лимонной кислоты берут такие количества, которые содержат от 100 до 500 мкг, разливают в пробирки по 3 мл. Далее определение лимонной кислоты ведут, как и в фильтрате эякулята после осаждения белков [Базарнова М. А. и др., 1979].
Иммунологические исследования. Выявление антисперматозоидных антител. Сперматогенный эпителий хорошо защищен от инфекционных и токсических воздействий гематотестикулярным барьером, который нарушается в исключительных случаях. Повреждение проницаемости или структуры этого гематотестикулярного барьера, образованного собственной оболочкой семенных канальцев и цитоплазмой сустентоцитов, играет существенную роль в патогенезе аутоиммунного бесплодия.
Антитела у самцов скапливаются в сперматогенном эпителии, нарушая тем самым процессы сперматогенеза. Различают три вида антител: сперматоагглютинирующие, сперматоиммобилизирующие и сперматогенные. Эти антитела вызывают агглютинацию и иммобилизацию спермиев, а также деструктивные изменения в сперматогенной ткани. Антигены содержатся не только в спермиях, но и в семенной жидкости. Следовательно, сперма может вызвать появление в организме антител не только к спермиям, но и к семенной жидкости.
Определение спермаагглютинирующей активности сывороток крови методом микроспермаагглютинации [Фраклин, Дюкс, 1984]. 1. Инактивация комплемента исследуемой сыворотки нагреванием при 56 °С в течение 30 мин. 2. Двукратные разведения сыворотки крови изотоническим раствором натрия хлорида в объеме 0,5 мл - от 1:2 до 1:256. 3. Доведение концентрации спермиев в эякуляте, используемом в качестве антигена, до 50X106/мл (добавляют изотонический раствор натрия хлорида). 4. Добавление антигена суспензии спермиев (0,05 мл) к серийным двукратным разведениям сыворотки крови. 5. Инкубация при 37 °С в течение 1 ч. 6. Учет результатов под микроскопом. Реакция положительная при наличии 10% агглютинированных спермиев и более. Отмечается тип агглютинации (хвост к хвосту, головка к головке или смешанный).
Определение спермагглютинирующей активности сыворотки крови методом макрос пермагглютинации [Кибрик С. и др., 1952]. 1. Инактивация комплемента исследуемой сыворотки крови при нагревании при 56 °С в течение 30 мин. 2. Приготовление антигена. Доведение содержания спермиев до 50Х106/мл путем добавления к исходному количеству половых клеток в эякуляте изотонического раствора натрия хлорида и равного объема 10% раствора желатина. 3. Двукратные разведения исследуемой сыворотки изотоническим раствором натрия хлорида в объеме 0,2 мл в преципитационных пробирках - от 1:2 до 1:256. 4. Добавление к разведениям исследуемой сыворотки крови равного объема сперматозоидно-желатиновой смеси. 5. Инкубация при 37 °С в течение 2 ч. 6. Макроскопический учет результатов реакции. Агглютинация проявляется образованием хлопьев в прозрачной среде суспензии. Определяется титр спермагглютинирующей активности.
Определение спермиммобилизирующей активности сыворотки крови [Изоджима С. и др., 1968]. 1. Анактивация комплемента исследуемой сыворотки нагреванием при 56 °С в течение 30 мин. 2. Приготовление антигена. Доведение концентрации спермиев до 50X106/мл (добавляют изотонический раствор натрия хлорида). 3. Добавление 0,25 мл раствора антигена в присутствии 0,05 мл раствора комплемента - сыворотки крови АВ IV группы и без него к 0,25 мл исследуемой сыворотки крови. 4. Инкубация при 37 °С в течение 1 ч. 5. Оценка реакции, определение содержания (в процентах) подвижных спермиев в каждой пробирке. Уменьшение их количества в исследуемой сыворотке крови на 50% и более в присутствии комплемента расценивается как положительная реакция.
Микроагглютинация по Баскину. Полагают, что при половых сношениях происходит резорбция специфических ферментов спермиев. Против всосавшихся ферментов в организме женщины образуются антиферменты (ингибиторы), которые подавляют подвижность спермиев мужа. Очевидно, название реакции микроагглютинации не верно, так как никакой агглютинации здесь не происходит.
Ход исследования. У обследуемой женщины берут 3-4 мл крови из вены и сразу центрифугируют для получения сыворотки. Суспензию спермиев мужа и другого мужчины с плодовитой спермой (контроль) готовят одинаково. Центрифугируют и осадок разводят изотоническим раствором натрия хлорида, так, чтобы в 1 мл суспензии содержалось 20 млн спермиев. Готовят 4 препарата на предметных стеклах: 1-й препарат - наносят каплю суспензии спермиев мужа; 2-й препарат - наносят каплю суспензии спермиев другого мужчины; 3-й препарат - наносят каплю сыворотки обследуемой женщины и каплю суспензии спермиев мужа; 4-й препарат - наносят каплю сыворотки крови обследуемой женщины и каплю суспензии спермиев другого мужчины (контроль). Капли перемешивают, покрывают покровными стеклами, которые по краям парафинируют и ставят в термостат при температуре 37 °С на 6 ч. Через каждые 30 мин определяют подвижность спермиев под микроскопом.
Проба положительна, если в препарате 3 уменьшается процент кинезиса спермиев значительнее, чем в остальных контрольных препаратах. Чем выше титр иммобилизации ингибирующих антител, тем быстрее понизится процент кинезиса и наступит полная иммобилизация спермиев, тем резче положительная проба и менее вероятно оплодотворение.
Биологические пробы. Проба на совместимость и пенетрационную способность спермиев. Если возникают сомнения в совместимости шеечной слизи и спермы, то применяют пробу Шуварского, модифицированную Гунером.
Обследуемая женщина приходит через 1-2 ч после полового акта, которому предшествовало воздержание от половой жизни в течение 4-5 дней. Берут каплю содержимого из шеечного канала и влагалища. При положительной пробе Шуварского-Гунера в шеечной слизи можно определить от 5 до 15 подвижных спермиев и более. Отсутствие спермиев или их подвижности в шеечной слизи указывает на отрицательную пробу. При отрицательной пробе Шуварского-Гунера необходимо поставить пробу Курцрока - Миллера. Эта проба проводится в срок предполагаемой овуляции. Для этого на предметное стекло помещают каплю свежей спермы диаметром 3 мм и такую же каплю шеечной слизи. Расстояние между каплями должно быть 3 мм. Капли покрывают покровным стеклом. При положительной пробе спермии проникают через границу слизи, при отрицательной - этого явления не наблюдается.
Чтобы выяснить причину отрицательного результата анализа (при исследовании эякулята или секрета), пользуются перекрестным пенетрационным тестом по Буво и Пальмеру. Исследуемый эякулят мужа соединяют с секретом посторонней женщины. Если спермии проникают в этот секрет, то причиной бесплодия являются патологические изменения у жены. Если секрет жены приводится в соприкосновение со спермой постороннего мужчины и его спермии проникают в этот секрет, то больным является муж. Если оба теста дают отрицательный результат, то к бесплодному браку "причастны" оба супруга, т. е. имеется неполноценность как спермиев, так и секрета влагалища.
Исследование секрета предстательной железы. При микроскопическом исследовании секрета предстательной железы обращают внимание на количество лейкоцитов и лецитиновых зерен в поле зрения. Увеличение количества лейкоцитов (свыше 6-8 в поле зрения) и уменьшение числа лецитиновых зерен характерны для хронического воспаления предстательной железы. Секрет следует собирать с помощью массажа предстательной железы после того, как больной помочится, чтобы смыть содержимое уретры. При подозрении на уретрит, если обычным путем получить секрет не удается, можно произвести исследование с помощью 3-стаканной пробы. Больной мочится в 2 чистых стакана (в первой порции получается смыв из уретры, вторая порция дает представление о наличии воспаления в верхних мочевых путях и мочевом пузыре). Третья порция мочи собирается после массажа предстательной железы и будет содержать элементы секрета предстательной железы, попавшие в заднюю часть уретры во время массажа.
Определение характера кристаллизации секрета предстательной железы является одним из методов оценки эндокринной функции яичек.
Методика по И. И. Ильину, Ю. Н. Ковалеву (1971) заключается в следующем. Каплю секрета предстательной железы наносят на тщательно обезжиренное стекло и высушивают при комнатной температуре, затем добавляют каплю изотонического раствора натрия хлорида и высушивают при комнатной температуре повторно, микроскопируют при малом и большом увеличении. Степень нарушения кристаллизации секрета оценивается по А. Н. Демченко (1966). У здоровых мужчин репродуктивного возраста кристаллизация секрета предстательной железы характеризуется типичным феноменом листа папоротника (3+). Андрогенная недостаточность или наличие простатита дают различные степени нарушения структуры кристаллов вплоть до их отсутствия (2 + ; +; -).
При наличии простатита важное значение для выявления бактериальной флоры имеет посев секрета предстательной железы или третьей порции мочи.
Гормональные исследования. Достоверным показателем внутрисекреторной функции мужских половых желез является определение содержания тестостерона и эстрадиола в плазме крови и суточной моче, а также суммарных 17-КС и их фракций. Для изучения патогенеза заболевания мужских половых органов большое значение имеет также определение гонадолиберинов (рилизинг-гормонов) в крови.
Наиболее точными являются радиоиммунологические методы определения гормонов, основанные на конкуренции меченного и немеченного гормонов (антигенов) за связь с антителами. Комплекс антиген - антитело преципитируется в осадок вторым антиглобулиновым антителом. После измерения радиоактивности по калибровочной кривой, построенной на основании стандартов, высчитывается содержание вещества в пробе. По нашим данным, у здоровых мужчин в возрасте от 20 до 40 лет содержание ФСГ в крови в среднем составляет (2,44 + 0,26) мгк/л, а ЛГ - (2,16 ±0,19) мкг/л. Уровень тестостерона у мужчин репродуктивного возраста достигает в среднем (4,9±0,38) мкг/л, а эстрадиола - (27,5±0,13) мкг/л.
Определение общего количества содержащихся в моче 17-КС может иметь некоторое диагностическое значение при оценке резервной функции яичек. Схема проведения пробы Н. Т. Старковой заключается в следующем.
В течение 2 сут собирают мочу для определения 17-КС. Затем больному вводят внутримышечно в течение 7 дней по 1 500 ЕД хорионического гонадотропина, а в 2 последних дня дают дексаметазон по 3 мг в день для подавления функции коры надпочечников. В 5-е, последние, сутки проведения пробы собирают мочу на определение содержания общих 17-КС. Если суточная экскреция 17-КС после нагрузки хориогонином увеличивается более чем на 10%, а после приема дексаметазона не изменяется, то резервная функция яичек считается удовлетворительной. Выявление резервной функции межуточной ткани яичек и гипоталамо-гипофизарной системы весьма важно при проведении стимулирующей терапии, поскольку гормональная стимуляция без достаточной резервной функции половых желез противопоказана. В настоящее время эта проба имеет лишь историческое значение, так как резервную функцию яичек более точно можно определить по возрастанию уровня тестостерона после стимуляции яичек хорионическим гонадотропином. В последние годы для определения резервной функции гипофиза и гипоталамуса используются пробы с прогестинами и рилизинг-гормонами.
Биопсия яичек. Гистологическое исследование биоптата яичек дает возможность определить степень патологического процесса или дегенеративных изменений в нем, способность герминативного эпителия к регенерации и судить о состоянии межуточной ткани, характеризующей эндокринную активность яичек (рис. 78). Она позволяет проводить дифференциальную диагностику между обтурационной и необтурационной формой аспермии и решить вопрос о показаниях к оперативному лечению стерильности. Биопсия показана больным с аспермией и нормально развитыми яичками. Применяется открытая биопсия яичка. Она проводится в амбулаторных условиях с соблюдением всех правил асептики. Ассистент двумя руками прижимает яичко к коже мошонки. Под местной инфильтрационной анестезией производят разрез кожи мошонки длиной 2,5 см и оболочек до появления в разрезе белочной оболочки яичка. Последнюю вскрывают лезвием бритвы на протяжении 0,5-0,6 см. Выбухающую паренхиму яичка иссекают с частью белочной оболочки. Образовавшийся небольшой дефект ушивают 1-2 тонкими кетгутовыми швами. Такие же швы накладывают на оболочку яичка и кожу мошонки.
Рис. 78. Гистологическая картина (X 400). а - нормальная гистологическая картина (зрелые сперматозоиды в просвете канальцев); б - терминальная аплазия (генеративный эпителий отсутствует); в - картина торможения сперматогенеза на стадии сперматид
Для гистологического исследования кусочки ткани фиксируют фиксатором Ценкера, Буэна или нейтральным формалином, заключают в парафин, и срезы толщиной в 4-5 мкм окрашивают гематоксилином или эозином.
При секреторном бесплодии наблюдается картина сперматогенеза на одном из этапов или же его отсутствие. У некоторых больных, несмотря на наличие анатомически неизмененных яичек и полное отсутствие клинических данных, обнаруживается хронический орхит. Сперматогенез в большинстве канальцев заторможен на различных этапах, местами определяются гибель и отторжение в просвет клеток семенного эпителия, уменьшение количества сперматогоний, картина интратубулярной "уборки" мертвых сперматогенных клеток путем фагоцитоза. В значительной части канальцев определяются гиалинизация базальных мембран, интратубулярный и перитубулярный склероз. У больных с экскреторно-обтурационным нарушением оплодотворяющей способности в биопсийном материале обычно обнаруживаются все стадии сперматогенеза. Это дает возможность решить вопрос о показаниях к оперативному лечению, заключающемуся в ревизии и пластике семявыносящих протоков.
При гистологическом исследовании обращают внимание на межуточную ткань. Увеличение или уменьшение клеток Лейдига в размерах, изменение их формы (они становятся овальными или круглыми), уменьшение зернистости, посветление цитоплазмы, появление в ней большого количества вакуолей (пенистая цитоплазма) являются признаками снижения их функциональной активности.
Генитография. Комбинированное рентгенологическое исследование семявыносящих путей (семенного пузырька, семявыносящего протока и придатка яичка) носит название генитографии (рис. 79). Она позволяет установить уровень сужения или облитерации семявыносящего протока, а также состояние начального отдела семявыносящего протока, хвоста придатка, семенных пузырьков. Активный воспалительный процесс мочеиспускательного канала и добавочных половых желез является противопоказанием для проведения этого вида исследования. Генитографию производят под местной анестезией путем пункции семявыносящего протока, извлеченного из небольшого разреза у корня мошонки. В просвет семявыносящего протока вводят 2 иглы с затупленными концами в тестипетальном и уретропетальном направлениях. Для исследования применяют водорастворимые контрастирующие вещества. Генитография нередко осложняется воспалительным процессом или рубцовым сужением семявыносящего протока и поэтому должна проводиться по строгим показаниям.
Рис. 79. Генитография яичек, а - односторонняя; б - двусторонняя
При оценке эякулята основными критериями оплодотворяющей способности его являются: количество спермиев в 1 мл, процент активно подвижных и морфологически нормальных форм (табл. 5).
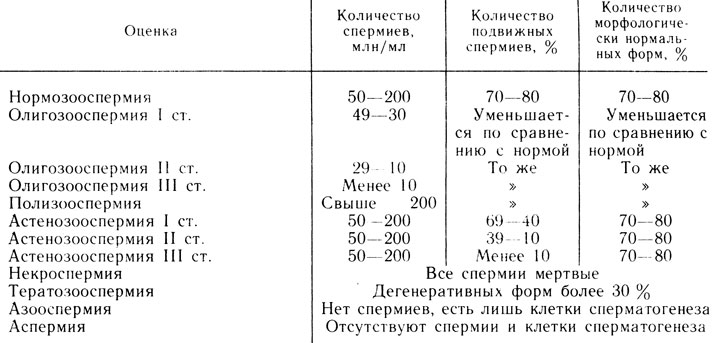
Таблица 5. Характеристика эякулята
Указанные нарушения сперматогенеза редко встречаются в чистом виде (олигозооспермия, астенозооспермия, тератозооспермия). Чаще наблюдается их сочетание в виде олиготератоастенозооспермии, что еще больше ухудшает оплодотворяющие свойства спермиев. Следует также отметить, что наличие агглютинации спермиев также отрицательно сказывается на качестве эякулята. При наличии нормозооспермии в бесплодном браке и отсутствии патологических изменений у жены следует проводить пробы на резистентность, дыхательную и пенетрационную способность спермиев.
Возможны следующие заключения: 1) плодовитость нормальная (нормозооспермия); 2) абсолютное бесплодие (некроспермия, азооспермия, аспермия); 3) относительное бесплодие (при несовместимости цервикального секрета и спермы); 4) плодовитость пониженная.
После исследования состояния сперматогенеза, определения патоспермии и эндокринологической картины следует установить клинический диагноз, который определит характер лечебных мероприятий.
Лечение бесплодия
После выявления нарушений функции половых желез на основании жалоб, анамнеза, исследования эякулята, секрета предстательной железы, исследования эндокринной функции гипофиз-гипоталамус-яичко и проведенной при необходимости биопсии, генитографии возможно назначение комплексной терапии с учетом выявленных нарушений.
Экскреторные формы мужского бесплодия, обусловленные неспецифическими воспалительными заболеваниями семявыносящих протоков, за исключением обтурационной аспермии, как правило, хорошо лечатся консервативными методами. Однако при этом требуется настойчивость лечащего врача, а также выдержка и терпение пациента.
При окклюзиях просвета семявыносящих путей, являющихся следствием перенесенных эпидидимитов, деферентитов, но при сохраненном сперматогенезе (данные биопсии яичка) показано хирургическое восстановление проходимости семявыносящих путей. Оперативное лечение необходимо при варикоцеле, водянке, крипторхизме. После хирургического лечения проводится консервативная терапия с учетом характера гормональных сдвигов.
Критериями эффективности лечения должны являться количество спермиев в 1 мл эякулята и качественные изменения спермограммы, такие как наличие живых, активно подвижных, морфологически нормальных спермиев, а также присутствие лейкоцитов и других патологических примесей, спермагглютинации, содержание фруктозы, лимонной кислоты и пр.
В любом случае следует тщательно обследовать жену больного и при необходимости обязательно лечить ее. При нормальной спермограмме и отсутствии заболеваний у жены важное значение придается резистентности спермиев, дыхательной, пенетрационной способности, наличию лейкоцитов, спермагглютинации, а также иммунологическому обследованию супругов.
Всякое лечение начинается с общих организационных и лечебных мероприятий: с устранения бытовых и профессиональных вредностей, нормализации режима труда, отдыха, питания больного, назначения седативной или антидепрессивной терапии, средств, повышающих антитоксическую функцию печени, витаминотерапии, с лечения сопутствующих заболеваний.
Общие организационные мероприятия. Следует исключить курение, употребление алкоголя, бесконтрольное применение лекарственных препаратов, которые могут сами по себе вызывать нарушение генеративной функции. Необходимо выявить и устранить воздействие вредных профессиональных факторов, так как они нередко могут осложнять положение, особенно при несоблюдении режима труда и невыполнении техники безопасности. Имеют значение постоянное переохлаждение и перегревание организма, воздействие ионизирующего излучения, лучистой энергии, токов высокой частоты, вибрации, шума, контакт с промышленными ядами. Необходимо устранить факторы, вызывающие депрессию, состояние страха, чрезмерные и длительные физические нагрузки. Всем больным следует рекомендовать ежедневное проведение утренней гимнастики, включающей упражнения, улучшающие дыхание, повышающие тонус мышц тазового дна, брюшного пресса. При малой физической нагрузке необходим активный двигательный режим (ходьба, плавание, работа в саду, подвижные спортивные игры). При физическом характере работы рекомендуется отдых с включением положительных психоэмоциональных нагрузок (посещение театра, кино, чтение художественной литературы).
Питание при всех формах бесплодия должно быть регулярным, пища - содержать достаточное количество белков, жиров, углеводов, витаминов, минеральных солей. В пищевой рацион следует включать продукты, богатые белками, содержащие незаменимые аминокислоты: мясо животных, птиц, морскую рыбу, яйца, творог, красную и черную икру. Обязательным является употребление растительного масла (подсолнечного, кукурузного, оливкового, арахисового). Необходимо включать в пищу свежие овощи и фрукты (картофель, свеклу, морковь, тыкву, абрикосы, яблоки, цитрусовые и др.). Приготовление салатов на растительном масле способствует усвоению жирорастворимых витаминов (A, D, Е, К). Высушенные фрукты служат поставщиками минеральных солей и микроэлементов. Людям с пониженным питанием рекомендуется употребление меда, который содержит витамины, биологически активные вещества, микроэлементы. Запрещается употребление чрезмерно острых блюд, приправ и копченостей.
При установлении режима половой жизни следует учитывать следующие факторы. Частые половые контакты приводят к ухудшению оплодотворяющей способности эякулята за счет уменьшения количества и появления молодых форм спермиев. Редкие половые сношения приводят к увеличению количества спермиев, но способствуют их старению, что также ухудшает оплодотворяющую способность эякулята. 3-5-дневное воздержание является оптимальным сроком для нормализации спермограммы у здорового мужчины. Повторные коитусы способствуют утечке спермы из влагалища. Следует также учитывать дни овуляции у женщины, так как лишь в этот период возможно зачатие. После полового акта жена должна оставаться в постели с приподнятым тазом в течение 30-40 мин, что способствует сохранению семенной лужицы у шейки матки.
Малофертильная сперма, попадая в половые пути женщины, способствует возникновению у нее иммунного бесплодия. Поэтому для предотвращения частого контакта с такой спермой и уменьшения концентрации спермагглютинирующих антител рекомендуется проводить половое сношение с презервативом и лишь в период овуляции у жены следует иметь половую связь без предохранения.
Общие лечебные мероприятия. Важное значение для нормализации синтеза стероидных гормонов, генеративной функции яичек имеет рациональная витаминотерапия. Назначают витамины А, Е, D, К, B1, В2. Имеются комбинированные препараты: витамин А с витамином Е в виде аевита и препараты, содержащие комплекс необходимых витаминов (гендевит, декамевит, ундевит, аэровит).
У инфертильных мужчин нередко развиваются неврозы, сопровождающиеся раздражением, астеническим состоянием, депрессией. Для улучшения деятельности нервной системы, а также при переутомлении и истощении ее следует назначать препараты фосфора (фитин, фитоферролактол, липоцеребрин, кальция глицерофосфат), глутаминовую кислоту. При депрессивных состояниях рекомендуется добавлять экстракт элеутерококка; настойки лимонника китайского, аралии, заманихи; стрихнин, секурин, прозерин.
При повышенном возбуждении и раздражительности больного назначают препараты брома, настойки пустырника, валерианы, календулы, цимицифуги. При более выраженных расстройствах ЦНС необходима консультация невропатолога, психотерапевта для назначения соответствующего лечения.
Для усиления антитоксической и метаболической функций печени рекомендуется применять метионин, липокаин, эссенциале, желчегонные средства в обычных дозах, а также проводить диетотерапию (стол № 5) и периодически слепое зондирование.
Биостимулирующая терапия применяется для активации физиологических процессов в различных органах и системах, в том числе и в половых органах, при этом происходит усиление обменных процессов, улучшение фагоцитарной активности ретикулоэндотелиальной системы, микроциркуляции, кровоснабжения, стимуляция восстановительных процессов в тканях. К биогенным стимуляторам относятся экстракт алоэ, биосед, ФИБС, пеллоидин, апилак, торфот, гумизоль, препараты плаценты, стекловидное тело, спленин, плазмол, полибиолин, раверон, пирогенал, продигиозан и др. Стимуляторами репарационного процесса в организме, в том числе и в половой системе, являются метилурацил и пентоксил.
Лечение секреторного бесплодия. Первичный гипогонадизм. При первичном (гипергонадотропном) гипогонадизме показано назначение андрогенных препаратов. Андрогены способны подавлять секрецию гонадотропных гормонов и восстанавливать сперматогенную функцию, воздействуя на заключительную фазу сперматомейоза. Таким свойством обладают тестостерона пропионат, метилтестостерон и др. Тестостерона пропионат вводится по 25-30 мг 2-3 раза в неделю внутримышечно. При сохраненной андрогенной резервной функции яичек курс лечения не должен превышать 2 ½ мес., после чего следует сделать 2-3-месячный перерыв, во время которого проводить лечение препаратами, действующими по типу ЛГ. К ним относятся хориогонический гонадотропин, или хориогонин, который вводят внутримышечно по 500-1 500 ЕД 2-3 раза в неделю в течение 4-6 нед. Таким образом стимулируется функция гландулоцитов яичка, что приводит к выработке собственного тестостерона.
Небольшие дозы андрогенов оказывают стимулирующее действие на придаточные половые железы, на генеративный эпителий и на организм в целом, даже в том случае, когда не наблюдается выраженных гормональных нарушений в системе гипофиз - яички. Для достижения подобного эффекта рекомендуется назначать таблетки метилтестостерона сублингвально по 5-10 мг ежедневно в течение 2-2 ½ мес. С этой же целью мужчинам с пониженным питанием можно назначать анаболические гормоны: метандростенолон (неробол) в таблетках по 5 мг 1-2 раза в день перед едой, курс лечения 4-6 нед с перерывами 1-2 мес; нероболил вводится в виде масляного раствора внутримышечно 1 раз в 7-10 дней по 25-50 мг, курс лечения 1 ½ мес, ретаболил, дающий сильный и длительный анаболический эффект, вводят внутримышечно по 25-50 мг 1 раз в 2-3 нед., так же действуют феноболин и силаболин.
Для заместительной терапии чаще применяют препараты пролонгированного действия, содержащие эфиры тестостерона: тестенат (сустанон-250, омнадрен-250). Масляный раствор тестената вводится внутримышечно по 200 мг каждые 3-4 нед, курс лечения 2 мес. Следует помнить о том, что большие дозы тестостерона могут приводить к угнетению сперматогенеза (вплоть до развития азооспермии) за счет торможения выработки гонадотропинов передней долей гипофиза. Вслед за отменой препарата через 2-3 мес наблюдается обратный эффект, происходят растормаживание передней доли гипофиза, восстановление сперматогенеза с увеличением количества и улучшения подвижности спермиев. При отсутствии резервной функции яичек проводится постоянная заместительная терапия указанными андрогенами. При лечении препаратами тестостерона следует проводить мероприятия по улучшению метаболической и антитоксической функции печени, так как именно в печени происходит распад тестостерона до 17-КС. При высоком содержании лютеотропного гормона (ЛТГ) - гиперпролактинемии - назначают ингибиторы секреции пролактина: бромкриптин, парлодел. Они обладают дофаминергическим свойством, подавляют секрецию пролактина. Применяются в дозе 2,5 мг 1 или 2 раза в день месячными циклами с перерывами в 5-10 дней на протяжении 2-3 мес. При лечении отмечаются увеличение концентрации ФСГ, ЛГ и тестостерона, повышение либидо, потенции, исчезновение гинекомастии, нормализация сперматограммы.
Вторичный гипогонадизм. Лечение вторичного (гипогонадотропного) гипогонадизма заключается в применении гонадотропинов, гонадолиберина или препаратов, стимулирующих их выделение.
При дефиците ГСИК (ЛГ) уменьшается его стимулирующее влияние на гландулоциты яичка, что приводит к снижению выработки тестостерона, с последующим торможением сперматомейоза и замедлением созревания спермиев в придатке яичка. В этом случае показано применение хорионического гонадотропина и его аналогов (хориогонина, антелобина, фоллютеина, гонабиона и др.), которые близки по своему биологическому действию к ЛГ. Препараты вводятся внутримышечно по 500-1500 ЕД от 1 до 3 раз в неделю в течение 6-8 нед. Хорионический гонадотропин повышает также продукцию эстрогенов значительно больше, чем тестостерона, что может приводить при длительном применении к дегенерации сперматогенного эпителия. Поэтому введение его можно сочетать с введением андрогенов надпочечникового происхождения, обладающих анаболическим свойством или чередовать с назначением препаратов, содержащих тестостерон. При отсутствии резервной андрогенной функции яичек лечение хорионическим гонатропином не имеет смысла. В таком случае следует проводить заместительную терапию тестостероном и другими андрогенами.
При дефиците ФСГ применяется менопаузальный гонадотропин. Менопаузальный гонадотропин содержит преимущественно ФСГ, активирующий сперматогенез, воздействуя на митотическую стадию сперматогенеза, он способствует увеличению количества семенных клеток и стимулирует их деление до сперматоцитов. Применяется менопаузальный гонадотропин по 75 ЕД внутримышечно 1-3 раза в неделю на протяжении 6-8 нед. Можно сочетать назначение менопаузального и хорионического гонадотропина. При недостаточной резервной функции гландулоцитов эффективность лечения повышается при комбинации менопаузального гонадотропина с препаратами тестостерона. Следует отметить, что длительное применение менопаузального и хорионического гонадотропина вызывает образование специфических антител, нейтрализующих их действие. Поэтому лечебные курсы не должны быть длительными и могут повторяться лишь после 6-8-недельного перерыва, до 4 раз в год.
При гипофизарной недостаточности показано также введение префизона (экстракта передней доли гипофиза), который содержит все гипофизарные гормоны, в том числе ФСГ и ЛГ. Префизон вводится внутримышечно или подкожно (25 ЕД) ежедневно или через день, на курс лечения 10-20 или 30 инъекций. Кроме гонадотропного эффекта, префизон оказывает тонизирующее действие на функцию других эндокринных желез.
Препаратами, стимулирующими функцию гипоталамо-гипофизарной системы, являются прогестины (кломифен, кломифен-цитрат, кломид, гравосан, клостильбегит В и др.). Являясь антиэстрогенами, они препятствуют нормальному функционированию отрицательной обратной связи, реализующей влияние половых гормонов на гипофиз и гипоталамус. Прогестины усиливают секрецию собственных гонадотропинов за счет стимуляции соответствующих гипоталамических центров. Это приводит к активации сустентоцитов и гландулоцитов, к повышению уровня тестостерона, эстрогенов в крови, к нормализации дозревания, отторжения спермиев в семенных канальцах и увеличению их количества в эякуляте. Прогестины назначают внутрь ежедневно, однократно по 25 мг циклами по 25-30 дней с интервалом в 7-10 дней. В отдельных случаях, если отмечается значительное улучшение спермограмм, длительность лечения может достигать 6 мес. При отсутствии улучшения после двух циклов дозу повышают до 50 мг. Из побочных эффектов лечения большими дозами могут иметь место гинекомастия, нарушение зрения, тошнота, проходящие при отмене препарата. К антиэстрогенам относятся также тамоксифен, зитозониум; они стимулируют гонадотропную функцию гипофиза путем вытеснения эстрогенов с их рецепторных зон. Тамоксифен применяется при нормо- и гипогонадотропной олигозооспермии по 10 мг 2 раза в день месячными циклами с перерывами в 7-10 дней. Отмечается повышение концентрации ФСГ, ЛГ и тестостерона в крови и, как следствие, значительное повышение концентрации спермиев в эякуляте.
Витамин А широко используется как антиэстроген, витамин Е - как синергист андрогенов. Витамины группы В способствуют дезактивации эстрогенов.
Вторичное дискорреляционное бесплодие, которое развивается вследствие нарушения функции желез внутренней секреции, следует лечить при постоянном наблюдении эндокринолога. При гипо- или гиперактивности коры надпочечников, щитовидной, шишковидной и других желез внутренней секреции необходима прежде всего корригирующая терапия, направленная на нормализацию их функции. Оперативное лечение секреторного бесплодия должно иметь место при сопутствующих водянке, грыже, варикоцеле.
Лечение экскреторного бесплодия. Терапия экскреторного бесплодия включает мероприятия, направленные на лечение заболеваний, а также их осложнений, которые обусловили развитие стерильности. Такие пороки развития, как эписпадия и гипоспадия, устраняют оперативным путем. При нежелании пациента оперироваться возможна искусственная инсеминация - введение его же эякулята в половые пути жены.
На первом этапе лечения экскреторного бесплодия, развившегося на фоне хронических воспалительных заболеваний мужских половых органов (уретрита, везикулита, простатита, эпидидимита и др.), необходимо включать длительную этиотропную терапию, характер которой зависит от вида выделенного микроорганизма. При этом следует учитывать, что большинство антибиотиков широкого спектра действия, сульфаниламидных препаратов, интрофуранов и пр. обладают гонадотоксическим свойством. Поэтому их следует применять с препаратами, предупреждающими отрицательное влияние на яички и повышающими дезинтоксикационную функцию печени (метионин, цистеин, липокаин в комплексе с витаминами группы В, С, РР, а также А и Е, эссенциале). Важно отдавать предпочтение антибактериальным средствам, обладающим хорошей проникающей способностью к месту воспаления в придаточных половых железах (тетрациклин, эритромицин, олеандомицин, триметаприм и др.). Для создания оптимальной концентрации целесообразно применять высокие дозы препаратов, но короткими курсами. Некоторые красители, например метиленовый синий, воздействуя на эписомы бактериальной клетки, лишают ее устойчивости к антибиотику. Поэтому до приема антибиотиков ежедневно однократно пациенту дается 0,1 г метиленового синего, растворенного в 30 мл воды. Для улучшения подведения антибиотиков к очагу воспаления следует использовать возможности физиотерапии с одновременным применением средств, усиливающих проницаемость измененных тканей, обладающих противовоспалительной и тромболитической активностью (димексид, трипсин, химопсин, рибонуклеаза, стрептолиаза, лидаза, гиалуронидаза, ронидаза и др.).
На втором этапе показана терапия, направленная на стимуляцию неспецифической иммунореактивности и адаптационных возможностей организма, улучшение трофики в пораженных органах и уменьшение образования грубой рубцовой ткани (лидаза, торфот, раверон, алоэ, ФИБС, полибоилин, продигиозан и др.), которую подкрепляют физиотерапией, лечебной гимнастикой и санаторно-курортным лечением. Из физиотерапевтических процедур применяются индуктотермия, импульсные токи низкой частоты, диадинамические, синусоидальные модулированные токи, ультразвук, гальванизация, электро- и фонофорез лекарственных средств и лечебной грязи. Для стимуляции сперматогенеза применяется физиотерапевтическое воздействие на лобные доли коры головного мозга, являющиеся высшими центрами управления половой функцией. Следует ограничивать назначения УВЧ и ультразвука на яички. Больным с длительно текущими хроническими заболеваниями половых органов в периоде неполной ремиссии рекомендуется санаторно-курортное лечение на курортах Железноводска, Бердянска, Саки и др.; используются грязелечение, аппликации парафина, озокерита, сероводородные, йодо-бромные и минеральные ванны. Необходима также тщательная санация мочеполовых органов жены пациента.
После купирования воспалительного процесса в органах половой сферы проводятся различные виды терапии, стимулирующей процесс сперматогенеза и андрогенную функцию яичек. Доказана эффективность игло- и лазерорефлексотерапии по предложенной нами методике (авторское свидетельство № 1 267 650 от 01.07.86 г.) при олигозооспермии. Методика заключается в воздействии на биологически активные точки поясничной области (щэнь-шу, яо-янгуань и мин-мэнь) стальными иглами или лучом гелий-неонового лазера ОКГ-13, имеющим длину волны 632,8 нм, плотность мощности на выходе до 10 мВт/см2, диаметр светового пятна 2 мм, при экспозиции 20 с последовательно на каждую точку. Процедуры как игло-, так и лазерорефлексотерапии проводятся ежедневно, по 12-14 на курс [Пупкова Л. С. и др., 1986; Тиктинский О. Л. и др., 1986]. Динамические гормональные исследования на фоне рефлексотерапии выявили активацию гипоталамо-гипофизарно-гонадной системы с последующей тенденцией к нормализации уровней гормонов в сыворотке крови. Иглорефлексотерапия вызывает более высокий выброс эстрадиола и ФСГ, а лазерорефлексотерапия - тестостерона и ЛГ. Поэтому в первом случае отмечено нарастание концентрации, во втором - количества подвижных спермиев. В связи с этим возможно поочередное применение игло- и лазерорефлексотерапии.
Лечение локальным отрицательным давлением при олигозооспермии в сочетании с эректильной импотенцией приводит к улучшению спермограммы за счет усиления кровоснабжения, оксигенации и возрастания явлений метаболизма не только в тканях полового члена, но и в яичках и придаточных половых железах. В последние годы при лечении бесплодия используется гипербарическая оксигенация с применением барокамеры. Описанная выше гормонотерапия показана при стойких гормональных нарушениях и патологической спермограмме, которые не нормализуются после противовоспалительной терапии и применения негормональных средств, направленных на улучшение гормонопоэза и метаболической функции печени. Критерием выбора метода гормонотерапии (стимуляция или замещение) служит степень сохранности резервов гипоталамо-гипофизарно-гонадной системы. При выраженной андрогенной недостаточности показано применение препаратов тестостерона (метилтестостерон, тестостерона - пропионат, тестобромлецит и др.), а также анаболических гормонов (нероболил, ретаболил, неробол, метандростенолон и др.). Дозы и длительность лечения устанавливаются индивидуально.
Оперативное лечение обструктивной аспермии. При двусторонней обтурации семявыносящих протоков или придатков яичек рекомендуется оперативное лечение. Клиническими и экспериментальными наблюдениями доказано сохранение сперматогенеза в яичках в течение длительного времени после нарушения проходимости семявыносящих путей. Сохранность сперматогенеза (до образования спермиев), подтвержденная биопсией яичка, является основным показанием к оперативному лечению при обструктивной аспермии.
Все способы хирургического восстановления проходимости семявыносящего протока в зависимости от места наложения анастомоза делятся на 3 основных группы (рис. 80): 1) анастомоз на протяжении семявыносящего протока (вазо-вазоанастомоз); 2) анастомоз семявыносящего протока с придатком яичка (вазо-эпидидимоанастомоз); 3) анастомоз семявыносящего протока с паренхимой яичка (вазотестикулоанастомоз). Операция наложения вазо-вазоанастомоза заключается в ревизии семявыносящего протока в резекции места обтурации и соединении концов семявыносящего протока с временным эндопротезом и без него. В качестве эндопротеза чаще применяется нейлоновый интубатор (рыболовная леска) соответствующего размера. Один конец интубатора вводят в проксимальный конец протока, другой - в просвет дистального отрезка семявыносящего протока и, проколов его стенку, выводят наружу через рану мошонки. Края сближают без наложения швов; швами, проходящими через адвентициальную оболочку; клеем; шовно-клеевым методом. Эндопротез удаляют через 7-10 дней после операции.
Рис. 80. Варианты анастомозов при обструкции семявыводящих путей, а - вазо-вазоанастомоз; б - эпидидимо-вазоанастомоз ('конец в бок'): в - эпидидимо-вазоанастомоз ('бок в бок'), г - вазотестикулоанастомоз
В основу хирургического лечения обструктивной аспермии нами положена методика эпидидимо-вазоанастомоза, при которой конец семявыносящего протока вшивается в бок придатка (рис. 80, б). Во время этой операции, которая проводится с использованием оптических систем, осуществляется ревизия придатка яичка, проверяется проходимость семявыносящего протока, решается вопрос о способе оперативного пособия, производится пластика семявыносящих путей. Операция включает 3 этапа.
I этап. Разрезом по переднебоковой поверхности мошонки обнажают яичко вместе с придатком и выводят в рану. Выделяют место перехода придатка в семявыносящий проток. Производят визуальную и пальпаторную ревизию придатка и семявыносящего протока. При этом нередко обнаруживают рубцовые изменения в области головки, тела, хвоста придатка и места перехода в семявыносящий проток. При осмотре часто определяется растянутая, переполненная секретом головка или весь придаток яичка, или сперматогранулемы в различных отделах придатка.
Прежде всего выясняют наличие проходимости семявыносящего протока в уретропетальном направлении. Для этого на операционном столе можно произвести деферентографию с введением в семявыносящий проток 2-3 мл водорастворимого контрастирующего вещества (трийотраст, уротраст, верографин и др.). Для установления проходимости в семявыносящий проток по игле в направлении к уретре можно ввести красящее вещество (метиленовый синий, индигокармин и др.). Появление его из уретры указывает на отсутствие облитерации семявыносящих путей. В противном случае приходится катетеризовать мочевой пузырь. Проходимость в таком случае устанавливается по появлению красителя в моче. Проходимость семявыносящего протока можно проверить и проведением интубатора в его просвет. Однако этот метод менее надежен, так как не дает полного представления о наличии или отсутствии обтурации семявыбрасывающего протока.
II этап. После установления хорошей проходимости семявыносящего протока в уретропетальном направлении решается вопрос о выборе вида анастомоза. При этом необходимо руководствоваться следующими соображениями: чем больший участок функционирующего придатка сохраняется при создании анастомоза, тем больше шансов у больного на восстановление плодовитости. На предполагаемом интактном участке хвоста придатка яичка производят разрез лезвием безопасной бритвы на протяжении 0,6-0,8 см. Выделившийся из разреза секрет наносят на предметное стекло и тотчас же исследуют под микроскопом. Если в мазках спермии не обнаруживаются, то производят такой же разрез в области тела придатка. При отрицательном результате исследуют секрет из разреза на головке придатка. При обнаружении спермиев в любом отделе придатка приступают к III этапу.
III этап. Эпидидимо-вазоанастомоз производят при обнаружении спермиев в любом отделе придатка яичка. В случае тотальной облитерации придатка можно наложить тестлкуло-вазоанастомоз. Малоэффективный в отношении оплодотворяющей способности пациента, он может способствовать восстановлению дренажной функции яичка, уменьшая аутоиммунные процессы. Таким образом, операция наложения тестикуло-вазоанастомоза может благоприятно повлиять на результаты пластической операции с контра- латеральной стороны в будущем.
При непроходимости семявыносящего протока в мошоночном отделе накладывают вазовазоанастомоз с резекцией облитерированного участка.
Эпидидимо-вазоанастомоз. Семявыносящий проток отсекают у хвоста придатка в косопоперечном направлении. Уровень пересечения протока зависит от обнаруженных в нем изменений. На проксимальный участок пересеченного протока накладывают кетгутовую лигатуру, и культю обрабатывают 5% спиртовым раствором йода. В дистальный конец семявыносящего протока проводят интубатор (леску с оплавленным концом) по направлению к уретре на 10-15 см, что позволяет дополнительно убедиться в хорошей проходимости. Косо срезанный дистальный конец протока рассекают на интубаторе на протяжении 0,8-1 см. Распластанный конец семявыносящего протока подводят к разрезу на придатке, где обнаружены спермии. Свободный конец интубатора надевают на иглу, через разрез в придатке и далее через ткань его выводят на поверхность придатка проксимальнее будущего анастомоза, а затем через ткани на кожу мошонки. Чтобы не повредить паренхиму придатка яичка, при проведении через будущий анастомоз интубатора мы пользуемся следующим способом. Проксимальнее разреза на придатке вкалываем инъекционную иглу подходящего размера и выводим конец ее в разрез на придатке. Через просвет иглы свободный конец лески проводим на поверхность придатка, после чего иглу удаляем, а леску с помощью хирургической иглы выводим на кожу мошонки. Атравматической иглой накладываем 4-6 швов. Швы захватывают все слои семявыносящего протока и оболочку придатка яичка, узлы швов располагаются снаружи. В последние годы применяется непосредственное сшивание рассеченного канальца придатка и семявыносящего протока с использованием операционного микроскопа. Двумя швами дистальнее образовавшегося анастомоза семявыносящий проток поверхностно подшивают к окружающим тканям, что препятствует перекручиванию и натяжению анастомоза. Яичко затем осторожно погружают в мошонку. Рану послойно зашивают. Интубатор удаляют через 7-10 дней.
Вазо-твстикулоанастомоз накладывают при тотальном поражении придатка яичка (рис. 80, г). После отделения головки от придатка яичка надрезают белочную оболочку в области средостения яичка. В разрез белочной оболочки и в виде заплаты вшивают подготовленную указанным выше способом культю семявыносящего протока. До наложения анастомоза интубатор выводят через разрез в яичке, белочную оболочку и далее на кожу мошонки.
Некоторые авторы отдают предпочтение эпидидимо-вазоанастомозу по типу "бок в бок" (рис. 80, в). Семявыносящий проток без пересечения подводится к придатку в месте предполагаемого анастомозирования. После рассечения стенок семявыносящего протока и придатка между ними формируется анастомоз на интубаторе, который выводится через придаток и кожу мошонки наружу. Интубатор удаляется на 7-10-й день после операции.
Все пациенты в ближайшем послеоперационном периоде должны получать лечение лидазой по 64 ЕД подкожно ежедневно, 15-20 инъекций на курс, или другими биогенными стимуляторами, препятствующими образованию грубой рубцовой ткани. Проводятся витаминотерапия и гормонокорригирующая терапия с учетом выявленных нарушений.
Первый контроль эякулята проводят через 3 мес, в дальнейшем - через 6-12 мес. Устранение аспермии, по нашим данным, достигается у 37,7% больных при проведении оперативного вмешательства с одной стороны и у 47% - при двустороннем оперативном лечении. Однако у большинства больных после пластики семявыносящих протоков сохраняется спермагглютинация, а в части наблюдений - значительная олигозооспермия, которые трудно поддаются лечению. Этим, очевидно, объясняется низкий процент наступления беременностей - у 39% женщин, мужьям которых была восстановлена проходимость семявыносящих путей [Михайличенко В. В., 1987; Тиктинский О. Л. и др., 1987].
Лечение иммунного бесплодия. Хроническое течение воспалительного процесса в уретре, придаточных половых железах может быть обусловлено сенсибилизацией организма к возбудителю, явлениями аутоагрессии вследствие образования антител к пораженным органам (предстательной железе, семенным пузырькам, придаткам) и спермиям. Может выявляться снижение глюкокортикоидной функции при экскреторно-воспалительном бесплодии, которое коррелирует со степенью падения общей иммунологической реактивности. При нарушении гематоорхического барьера любого генеза у мужчин возможно также появление аутоиммунного бесплодия. Иммунные процессы могут возникать и у женщин на попадание в ее половые пути малофертильной спермы. Диагноз устанавливается лишь при обнаружении в крови супругов агглютинирующих и цитотоксических антител по отношению к спермиям. В таком случае следует рекомендовать супругам проводить половой акт с презервативом (для уменьшения антителобразования в организме жены), не следует предохраняться лишь в период предполагаемой овуляции. Одновременно возможно проведение иммуносупрессивной терапии. В качестве десенсибилизирующей терапии применяют супрастин, димедрол, диазолин, тавегил, кальция хлорид, кальция глюконат, ацетилсалициловую кислоту. Препараты назначают в первую половину менструального цикла жене или мужу (в зависимости от выявленных нарушений). Для достижения иммуносупрессивного, десенсибилизирующего противовоспалительного и антиаллергического эффекта в случае выраженной аутоиммунизации применяются глюкокортикоиды (гидрокортизон, дексаметазон, преднизолон, бетаметазон и др.). Возможно местное (в виде свечей, электро- и фонофорез) и пероральное применение. Назначают небольшие дозы и непродолжительные повторные курсы лечения в первой половине менструального цикла под наблюдением эндокринолога или иммунолога. Преднизолон рекомендуют принимать по 5 мг 1 раз в сутки в течение 15 дней. Такая терапия способствует снижению титра агглютинирующих антител. Для проведения целенаправленной иммунной терапии важно оценить состояние гуморальных и центральных звеньев иммунитета (фагоцитарная активность, содержание иммуноглобулинов, состояние Т- и В-системы). Выбор лекарственных средств, воздействующих на иммунные реакции, должен проводиться с учетом состояния иммунитета в целом. Иммуностимулирующая терапия назначается при хроническом воспалительном процессе и при длительной антибактериальной терапии, подавляющей иммунную реактивность организма. Пентоксил, метилурацил, натрия нуклеинат и др. повышают защитные силы организма путем активации лейкопоэза, фагоцитарных реакций и стимуляции регенеративных процессов. Биогенные стимуляторы повышают естественную резистентность организма, мобилизуя клеточные и гуморальные механизмы антимикробной защиты, способствуют восстановлению иммунологического гомеостаза.
Иммуномодулирующими средствами, повышающими функциональную активность и нормализующими количества иммунокомпетентных клеток с усилением фаголимфоцитарной реакции, являются левамизол (декарис), тималин, Т-активин и В-активин. Декарис назначают внутрь по 150 мг, однократно в течение 3 дней, через 4 дня лечение повторяют. Тималин назначают по 10 мг ежедневно, внутривенно, в течение 10 дней. Препараты улучшают эффект лечения при аутоиммунных процессах в организме. К специфическим иммуностимуляторам относятся различные виды вакцины, в том числе аутовакцины, специфические α-глобулины.
Методом выбора при иммунном бесплодии является искусственная инсеминация - введение в канал шейки матки или в полость матки жены свежеполученной спермы мужа.
При относительном бесплодии рекомендуется проводить общие организационные и лечебные мероприятия, заключающиеся в соблюдении режима труда, отдыха, рационального питания, режима половой жизни; витаминотерапию; искусственную инсеминацию спермой мужа.
Лечение сочетанного бесплодия начинается с терапии воспалительных заболеваний уретры и придаточных половых желез или восстановления проходимости семявыносящих путей, т. е. устраняются экскреторные компоненты бесплодия. Затем приступают к ликвидации секреторных факторов бесплодия, заключающейся в проведении рациональной гормональной терапии с учетом выявленных нарушений. При этом применяются те же принципы лечения, что и при изолированных формах бесплодия.
Всегда следует помнить о том, что при лечении бесплодия нельзя пользоваться какими-то определенными схемами. В каждом конкретном случае следует пользоваться комплексом разнообразных средств применительно к данному конкретному больному с учетом этиологических, патологических и индивидуальных особенностей.
Профилактика мужского бесплодия заключается в раннем выявлении аномалий развития половой сферы, в лечении и предупреждении заболеваний, отрицательно влияющих на генеративную и капулятивную функции.
В этом плане должны тщательно проводиться антенатальная охрана плода, диспансеризация и последующее плановое лечение новорожденных с аномалиями развития половых органов (гипоспадия, эписпадия, крипторхизм и др.), предупреждение инфекционных заболеваний у детей.
В период полового созревания важное значение приобретают гормональное лечение гипогонадных состояний и других эндокринных нарушений, правильное и своевременное оперативное лечение таких заболеваний, как грыжа, варикоцеле, водянка.
В зрелом возрасте особое внимание следует придавать осмотрам и диспансерному наблюдению мужчин с вредными условиями труда, терапии воспалительных заболеваний мочеполовых органов, профилактике всех видов травматизма.
Санитарно-просветительная работа должна быть направлена на соблюдение режима труда и питания, половой жизни, на профилактику венерических болезней, предотвращение бесконтрольного применения лекарственных средств, злоупотреблений никотином и алкоголем.
Следует надеяться, что дальнейшие цитогенетические, радио-, иммунологические и биохимические исследования при бесплодии, внедрение микрохирургической техники, появление новых препаратов, организация отделений искусственной инсеминации помогут решить существующие проблемы в диагностике, лечении и профилактике бесплодного брака.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'