Глава 7. Новообразования предстательной железы и семенных пузырьков (Тиктинский О.Л.)
Аденома предстательной железы (парауретральных желез)
Терминология при этом заболевании носит принципиальный характер. С позиций морфолога, это доброкачественная, гормонально-зависимая опухоль. На протяжении десятилетий и до сравнительно недавнего времени широко применялся термин "гипертрофия" предстательной железы. Наряду с этим высказывались мнения и об иной природе заболевания. В 1936 г. на нашей кафедре Н. М. Борисовским была защищена докторская диссертация, которая называлась "О так называемой гипертрофии предстательной железы". В ней и более ранних работах автор доказал гормональную зависимость возникновения аденомы, а не гипертрофии предстательной железы [Борисовский Н. М., 1936]. Вопрос о втором названии заболевания появился с накоплением фактов о росте аденомы из парауретральных желез. Следует ли из этого, что надо менять номенклатуру заболевания, его название? По-видимому, нет. Во-первых, потому, что парауретральные железы, как и предстательная железа, в процессе эмбриогенеза образуются из одного зачатка. Они одинаково подвержены влиянию эстрогенов; кроме того, краниальный (центрально-уретральный) отдел предстательной железы и парауретральные железы представляют собою как бы единое целое. Во-вторых, отходить от привычного названия аденомы предстательной железы в пользу парауретальных желез не следует, так как оно прочно вошло во врачебную практику и хорошо знакомо больным. Следует, однако, отметить, что ряд авторов все же признают возможность гипертрофии предстательной железы, так же как гипотрофию ее, что, несомненно, имеет место у части больных в пожилом и старческом возрасте.
Fr. Hinman и его многочисленные соавторы свою весьма объемную и обстоятельную монографию назвали "Доброкачественная гипертрофия простаты" [Bening Prostatic Hypertrophy.- Springer Verlag.- New York - Berlin, 1983]. Однако их трактовку патогенеза аденомы предстательной железы в этом вопросе можно и оспаривать.
Эпидемиология. Аденому предстательной железы (АПЖ) можно отнести к самому распространенному заболеванию у мужчин. При жизни увеличение предстательной железы, рассматриваемое как аденома ее, выявляется у каждого 6-7-го мужчины старше 50 лет [Дунаевский Л. И., 1959]. При аутопсии мужчин старше 60 лет АПЖ обнаруживается в каждом третьем случае. Наличие АПЖ нельзя, тем не менее, всегда отождествлять с самим заболеванием. При так называемой ректальной форме АПЖ основная масса ее растет в сторону прямой кишки, не оказывая давления на предстательную часть уретры, и могут полностью отсутствовать симптомы заболевания. Выявить их можно при профилактических осмотрах во время диспансеризации.
Под нашим наблюдением находится небольшая группа мужчин в составе 27 человек с ректальной формой АПЖ. За 8 лет 26 из них практически здоровы, что подтверждается и лабораторными данными. Лишь у 1 больного, 63 лет, полтора года тому назад наступила острая задержка мочи, обусловленная приемом большого количества алкоголя и охлаждением. Мочеиспускание восстановилось после 2 катетеризаций, но в последующем появились весьма умеренные дизурия и никтурия. Спустя 7 мес больному по его настоянию произведена аденомэктомия, послеоперационный период протекал без осложнений.
Заболевание имеет повсеместное распространение, но есть и исключения. Больных АПЖ почти нет в Японии и Китае, у африканских чернокожих. Существует мнение, что это в какой-то степени объясняется характером питания, преобладанием в этих странах в рационе людей растительных жиров. Возможно, этим обусловлена и некоторая урбанизация. В сельской местности это заболевание встречается несколько реже. Имеется корреляция с ожирением и атеросклерозом. Возможно, она обусловлена одновременным влиянием не только одного этиологического гормонального фактора. Это - заболевание мужчин пожилого, старческого и реже среднего возраста.
Патологическая анатомия. АПЖ, возникшая из парауретральных желез, расположенных в окружности предстательной части уретры, может иметь различную конфигурацию. Она состоит из 2 или 3 долей, которые ничего общего не имеют с долями собственно предстательной железы. Собственно предстательная железа к этому времени оттесняется аденомой под большим давлением к периферии и атрофируется. В основном она превращается в хирургическую капсулу, на границе с прямой кишкой - в тонкую пластинку, где в незначительной степени сохраняются и элементы паренхиматозной ткани. По конфигурации возможны несколько вариантов АПЖ. Она может состоять из двух долей боковых, из одной средней, трех долей или быть гроздевидной. Для боковых долей характерна асимметрия по величине и конфигурации. Однако поверхность аденомы гладкая, консистенция эластическая, гомогенная. Характерна конфигурация внутреннего отверстия уретры, где растянут внутренний сфинктер мочевого пузыря; оно выглядит кратерообразным и в то же время в виде щели, иногда раздвоенной.
Размеры ее коррелируют с массой. Малой считается аденома до 30 г, средней - до 70 г, большой - до 250 г. Возможны и гигантские АПЖ. В зависимости от топографии различают внутрипузырную, ректальную и смешанную формы ее. От этого зависят и клинические проявления. О ректальной форме уже упоминалось. Пузырная характеризуется прежде всего расстройством акта мочеиспускания. У таких больных может быть аденоматозной только средняя доля, но ее воздействие на внутренний сфинктер мочевого пузыря довольно выраженное. Предстательная часть уретры сдавлена, слизистая оболочка отечная. Это приводит к поллакиурии, никтурии, странгурии и дизурии, возможна острая и хроническая задержка мочи. Нередко рост аденомы носит равномерно-диффузный и промежуточный по отношению к двум крайним формам характер. Так называемые пузырные симптомы при этом также имеют место, но они могут быть мало выраженными, даже при аденоме больших размеров. Острая задержка мочи наступает при возникновении конгестии в венах таза вследствие приема алкоголя, порой весьма незначительного, после полового перевозбуждения, простудных заболеваний, алиментарных погрешностей и пр.
Гистологическая структура этой доброкачественной опухоли железистая (аденома), с фиброматозными элементами (фиброаденома), с мышечными волокнами (адемиома) или смешанная. S. Berry и соавт. (1984) считают АПЖ, с морфологических позиций, мультифакторальным процессом. По их мнению, на операции чаще удаляют фибромиоаденоматозные узлы.
АПЖ вызывает затруднение мочеиспускания, обусловленное сдавлением предстательной части уретры, клапанным закрытием внутреннего отверстия ее увеличенной средней долей, ущемлением аденомы в шейке мочевого пузыря и даже в результате рефлекторных влияний. В начале заболевания расстройства мочеиспускания предотвращаются или компенсируются напряжением детрузора, что может в некоторых случаях длительное время приводить к полному опорожнению мочевого пузыря. Но по мере роста АПЖ появляются расстройства акта мочеиспускания, что приводит к морфологическим изменениям в стенке мочевого пузыря. Наступает гипертрофия детрузора. Постепенно часть мышечных волокон его заменяется соединительнотканными. Объем мочевого пузыря увеличивается. Стенки его истончаются. Могут появиться вторичные дивертикулы. Возможно образование камней в мочевом пузыре, чаще они попадают в него из почек и мочеточников у больных мочекислым уролитиазом, у камневыделителей. Задерживаясь в мочевом пузыре, они увеличиваются и принимают характерную для. камней-уратов фасеточную форму. На слизистой оболочке мочевого пузыря появляются участки гиперемии, эрозии и даже некроза. Постепенно она гипертрофируется. Развившийся цистит и перицистит ведут к поражению регионарных лимфоузлов, откуда патогенные бактерии, чаще грамнегативные, поступая в ток крови, попадают в почки. При хронической или острой задержке мочи возможен и восходящий путь проникновения инфекции в почки посредством пузырно-мочеточниковых рефлюксов.
Присоединившийся пиелонефрит, протекающий в основном латентно или хронически, морфологически характеризуется инфильтративным или продуктивным процессом в межуточном веществе мозгового слоя с поражением почечных канальцев. При задержке мочи возможны вторичное проникновение патогенных бактерий в корковый слой почки и возникновение острого апостематозного пиелонефрита с инфильтративным и гнойничковым поражением, слиянием гнойничков и появлением участков некроза (карбункул почки), с возможным образованием под фиброзной капсулой сливных абсцессов (субкапсулярный абсцесс). Осложнение уросепсисом приводит к токсическому поражению печени и других внутренних органов, что особенно выражено при почечной недостаточности и у больных сахарным диабетом.
Этиология и патогенез. Влияние предстательной железы на функцию мочевыведения предугадывалось еще в глубокой древности. Герофил, Гиппократ, Сенека и другие уже знали и писали о задержке мочи, которая чаще имела место у мужчин старческого и пожилого возраста. Как об органе, воздействующем на жизненные силы организма, о предстательной железе ученые эскулапы древности стали думать после многовековой ошибки владык Востока. Набирая в стражу своих гаремов провинившихся на полях сражений воинов, они кастрировали их в период половой зрелости. Потеря при кастрации 1/3 потока андрогенов из клеток Лейдига (2/3 поступают из коры надпочечников) не приводила полностью к отсутствию способности к копуляции, чему в некоторой степени способствовала предстательная железа. Спустя несколько веков в евнухи стали брать мальчиков. Кастрация их до полового созревания приводила к появлению больших эндокринных сдвигов. Наружные половые органы, предстательная железа у них оставались недоразвитыми. Появлялись признаки феминизации ("женская полнота", "бабье лицо" и безучастный взгляд - такого евнуха можно увидеть на знаменитой картине Верещагина). Позже наблюдения отечественных авторов Е. В. Пеликана (1875) и А. Г. Подреза (1896) над скопцами и меринами выявили взаимосвязь между предстательной железой и половыми железами, что позволило в дальнейшем прийти к нескольким теориям этиологии АПЖ. Это и теория Ж. Т. Гюйона (1888) о зависимости АПЖ и расстройствах функций всей мочевой системы. Было мнение о связи этого заболевания с общим артериосклерозом.
S. Ciechanowsky (1900) считал, что АПЖ - результат длительно протекающего простатита. Albarrani, Halle рассматривали ее как обычное новообразование. Ближе к истине были сторонники внутрисекреторного происхождения этого заболевания. Ф. И. Синицын (1888) впервые в мире произвел кастрацию двум больным с АПЖ. Ошибочно он связывал возникновение ее с гиперфункцией половых желез. Ф. И. Синицын правильно предполагал влияние яичек на предстательную железу. О дисгормональной природе АПЖ высказывались А. В. Айвазян (1957), А. Я. Абрамян (1970) и ряд иностранных авторов.
В настоящее время вопрос об этиологии и патогенезе АПЖ нельзя считать окончательно решенным, но очевидным является то, что речь здесь идет о дисгормональной доброкачественной опухоли. Источником и местом зарождения ее являются периуретральные железы, известные еще и под названием парапредстательных и рудиментарных. Их выводные протоки открываются не в непросвет мочеиспускательного канала, а в железки-ацинусы, из которых состоит предстательная железа. О зависимости и единстве периуретральных желез и предстательной железы свидетельствует также и одинаковое происхождение их из урогенитального синуса и ductus paramesonephricus. Н. М. Борисовский (1933) считал, что все железы предстательной части мочеиспускательного канала, шейки мочевого пузыря, а также расположенные на границе перепончатой части уретры являются собственно простатическими. М. Енфеджиев назвал их "парапростатой", считая, что, несмотря на анатомические и функциональные различия с предстательной железой, они обладают внутренней секрецией и антагонизмом по отношению к половым железам.
Среди основных теорий этиологии АПЖ эстрогенная подкупает своей простотой и логикой. На фоне естественных возрастных изменений в организме мужчины после 50-60 лет, а у некоторых и после 40 лет наступают нарушения гормонального баланса в виде относительно и в небольшой мере абсолютного преобладания эстрогенов, что прежде всего связано со снижением функции гландулоцитов яичек. Это приводит к изменениям в так называемой парапростате, и в одной из периуретральных железок начинается опухолевый процесс. Аденоматозная пара- или периуретральная железа постепенно увеличивается, оттесняет предстательную железу кзади и к периферии. При этом возникают описанные выше патологоанатомические изменения.
Однако эти положения, как и надо было ожидать, подверглись экспериментальной проверке. Результаты их нарушили стройность эстрогенной теории генеза АПЖ. Л. И. Дунаевский (1959) в своей фундаментальной работе приводит данные исследований, выполненных Л. М. Шабадом (1949). Кажущееся их противоречие свидетельствует прежде всего о неодносложности этиологии данного заболевания [Ключарев Б. В., 1947; Коноплев В. П., 1953]. Авторы показали, что ПЖ одинаково чувствительна как к андрогенам, так и к эстрогенам, введение которых животным ведет к увеличению предстательной железы, к гиперплазии железистого эпителия. Первичный очаг аденомы все же возникает не в предстательной железе, а в периуретральных железах на границе шейки мочевого пузыря и семенного бугорка. Наступающая гипертрофия предстательной железы зависит от воздействия и преобладающих в гормональном балансе эстрогенов, и андрогенов. Однако чувствительность к эстрогенам периуретральных желез была явная. Б. В. Ключарев (1947, 1954) дал правильную характеристику АПЖ как дисгормональной опухоли, развивающейся из периуретральных желез. Однако им же установлены значительные изменения и в резко увеличенной собственно предстательной железе в виде метаплазии эпителия железокцинусов в многослойный плоский, частично в ороговевший. Отмечена и возможность обратного развития процесса спустя 2-3 мес после прекращения введения полианоля. Обратное развитие гипертрофии предстательной железы наблюдалось и в экспериментах Б. И. Монастырской (1964). Возможность возникновения гипертрофии собственно предстательной железы можно объяснить неоднородной гормональной чувствительностью определенных анатомических зон органа.
В экспериментах на мышах это успешно было показано R. Geissendorfer (1960). Автор различал у этих животных 3 отдела предстательной железы, неодинаково подвергающихся воздействию женских и мужских половых гормонов. Эти отделы были названы: "простата I, II и III".
В. И. Рождественский еще в 1954 г. своими исследованиями доказал влияние женских половых гормонов на соединительнотканную строму железы, вызывающих сморщивание ее. Клинический эффект (уменьшение странгурии, полиурии, никтурии) зависел от того, как повышался тонус детрузора при снижении активности сфинктера. Склерозирование предстательной железы, наступающее под действием эстрогенов, осложняет аденомэктомию, что и имело место в 50-е годы, когда синэстролотерапия была широко распространена. Лечение АПЖ андрогенами оказывает противоположное действие на иннервацию мочевого пузыря. Однако влияние гормональной терапии на АПЖ имеет мало общего с этиологией заболевания.
Аналогия с АПЖ человека среди животных в чистом виде встречается у стареющих собак. Тем не менее гистологически в увеличенной предстательной железе этих животных, вызывающей затруднение мочеиспускания, всегда определяется гипертрофия, а не АПЖ. Введение половых гормонов вызывает также гипертрофию-гиперплазию. Не совсем ясно, какое место занимает гиперплазия предстательной железы у больных АПЖ.
Не исключается возможность того, что в генезе аденомы гиперплазия собственно предстательной железы может быть ранним этапом, когда действие андрогенов прежде сказывается на краниальной зоне предстательной железы, а затем уже - на периуретральных железах. Не исключена возможность, что в начале заболевания мы пальпируем у больных увеличенную именно предстательную железу. В последующем увеличивается аденоматозно пораженная периуретральная железа, называемая аденомой предстательной железы, которая постепенно сдавливает собственно железу, вызывая ее дистрофию, образуя хирургическую капсулу.
Имеется и андрогенная теория. Сторонниками ее были Л. И. Дунаевский (1935, 1959) - автор первых фундаментальных монографий в нашей стране, А. Б. Топчан и А. А. Померанцев (1949). P. Robel (1985) пишет о противоречиях в гормональной теории возникновения АПЖ. Так, у собак АПЖ можно получить при введении дигидротестостерона и андростандиола, особенно в сочетании с эстрадиолом. Есть сторонники гипотезы о роли тестостерона в генезе АПЖ. М. Krieg и соавт. (1985) считают, что накопление 5α-дигидротестостерона является определяющим фактором в возникновении АПЖ у человека.
В пользу эстрогенного генеза АПЖ свидетельствуют и результаты исследований J. Hernandez и соавт. (1983). У больных этим заболеванием, леченных метилтриенолом, установлена статистически достоверная обратная зависимость между массой АПЖ и уровнем андрогенных рецепторов, содержащих цитоплазмин, а также прямая зависимость между уровнями дегидроэпиандрогестерона и концентрацией рецепторов. Гормональные теории образования АПЖ не исключают одновременное влияние и других этиологических факторов. J. Larul и соавт. (1985) установили, что ткань предстательной железы богата цинком, который накапливается только в секретирующих эпителиальных клетках. Накопление его может сочетаться с гиперплазией предстательной железы, исчезновение - с развитием РПЖ. Возможно, цинк участвует в регуляции обмена тестостерона в предстательной железе. Содержание его ниже 350 мг/г в предстательной железе указывает на возможность возникновения другой опухоли, рака. В предстательной железе цинк находится в связанном виде. Лиганд цинка обнаружен и в семенной плазме. Цинк связан с цитратом цитозоля предстательной железы, особенно в гиперплазированной, аденоматозной. Под влиянием андрогенов размер связи цинка с цитратом уменьшается - появляется много свободного цинка, отмечаются задержка в клетках и уменьшение свободного тестостерона и накопление цитрата.
Предстательная железа с "парапростатой", включающей периуретральные железы, является, как уже отмечалось, гормонально-зависимым органом. По теории J. Gilernet (1962) о простатогонадной корреляции, развитие предстательной железы регулируется половыми железами: гландулоцитами - каудальный, или периферический, отдел ее, сустентоцитами, в которых вырабатывается второй тестикулярный гормон, - краниальный, или центральный, и промежуточные отделы. В то же время и яички, и предстательная железа находятся под влиянием гонадотропинов гипофиза и вегетативных центров гипоталамуса. Согласно исследованиям А. С. Портного (1970, 1979) и по его анализу литературы в этом вопросе, снижение функции половых желез у мужчин, возникающее в пожилом или даже среднем возрасте, отмечается в большинстве наблюдений. Однако оно является все-таки не столько физиологическим, сколько патологическим процессом. Инкреция половых гормонов яичками осуществляется под контролем коры надпочечников, выделяющей 2/3 половых гормонов, и регулируется гипофизом. Гонадотропины влияют непосредственно на предстательную железу, на яички и кору надпочечников. Обратное влияние яичек на гипофиз осуществляется путем снижения уровня тестостеронов и гормонов яичка ингибином. Падение уровня гормонов яичка в крови больных является все же основным в регуляции обратной связи с центральными регулирующими системами. Понижение функции половых желез стимулирует гиперпродукцию гонадотропинов гипофизом. Первое время потеря части половых гормонов, продуцируемых яичками (в норме они составляют 1/3), компенсируется повышенной секрецией половых гормонов коры надпочечников. По мере нарастания дефицита андрогенов яичка возрастает и гиперпродукция гонадотропинов гипофизом. В конечном итоге гормональный баланс нарушается в сторону преобладания эстрогенов, несмотря на скопление метаболитов тестостерона (дегидротестостерона). Дисгормональная природа АПЖ, таким образом, в большей степени обусловлена снижением функции половых желез и преобладанием эстрогенов в гормональном балансе мужчины.
Роль некоторых метаболитов тестостерона в этом процессе указывает на сложность генеза заболевания, регуляция которого осуществляется на уровне гипофиза, вегетативных центров гипоталамуса.
Симптоматика и клиническое течение. Клинические симптомы АПЖ обусловлены ее топографоанатомическими особенностями. В основном они сводятся к расстройствам акта мочеиспускания. Затруднения его приводят к уменьшению струи мочи, к поллакиурии. Прилив крови в вены таза в ночное время вследствие обильных анастомозов ведет к конгестии предстательной железы, к веностазу в подслизистом слое предстательной части уретры. Это приводит к никтурии. Повелительные позывы на мочеиспускание со временем сменяются дизурией. Странгурия зачастую является более поздним симптомом. Нарушения акта мочеиспускания могут привести к задержке мочи, острой или хронической, которую можно рассматривать и как симптом болезни, и как осложнение. Последующие симптомы уже связаны с присоединившимися осложнениями. Это гематурия, выраженная дизурия при цистите, боли в поясничной области и лихорадка при пиелонефрите. Эти и некоторые другие симптомы нужно рассматривать в зависимости от 3 стадий АПЖ, которые были предложены Гюйоном [Guion J., 1899].
I называют стадией предвестников. Начальным симптомом зачастую является поллакиурия, которая может быть длительной. Со временем появляются никтурия и ослабление струи мочи. По мнению А. В. Айвазяна (1957), больной как бы "мочится себе под ноги" или некоторое время не может начать мочится. Но в этой стадии заболевания детрузор полностью справляется с затруднениями акта мочеиспускания и мочевой пузырь полностью опорожняется, остаточной мочи нет. Тем не менее и в первой стадии АПЖ может наступить острая задержка мочеиспускания. Она может быть вызвана приемом алкоголя, половыми излишествами, переохлаждением, приемом острой пищи, интеркуррентными заболеваниями, особенно такими, которые требуют постельного режима. Однако острая задержка мочеиспускания в I стадии заболевания - явление редкое. Более вероятно, что она может иметь место у больных с большой АПЖ.
II стадия заболевания характеризуется симптомами, обусловленными нарушением функции детрузора, который не может полностью опорожнить мочевой пузырь. Ранее имевшиеся симптомы становятся более выраженными. Струя мочи истончается. Больной мочится в несколько этапов. Появляется чувство неполного опорожнения мочевого пузыря, что на самом деле имеет место. Остаточная моча при этом составляет 50-400 мл и выше; клиническое значение имеет 100 мл и более. Поллакиурия переходит в дизурию, которая все же умеренно выражена и пока еще может не зависеть от воспалительного процесса. Хроническая задержка мочи иногда развивается исподволь и может длительно не выявляться. Острая, полная задержка мочеиспускания порой наступает почти без видимых причин. Катетеризация может привести к восстановлению мочеиспускания, многое зависит от степени конгестии таза и отечности предстательной железы.
III стадия АПЖ характеризуется полной декомпенсацией детрузора, неспособного опорожнить мочевой пузырь, переполненный мочой. Растянутый внутренний сфинктер уретры зияет в виде кратера или широкой щели. Растянут и находится в состоянии пареза и наружный сфинктер мочевого пузыря. Объем переполненного мочой пузыря достигает 1000 мл и более. В сущности, это - хроническая задержка мочи, но перерастянутый внутренний сфинктер не препятствует выделению ее по каплям. Такое мочеиспускание называют парадоксальным, так как оно происходит при задержке мочи. В старой немецкой литературе это состояние называли "течение мочи через край мочевого пузыря". Такое истечение мочи каплями может прекратиться, и наступит полная задержка мочи.
Появление новых методов функциональной диагностики заболеваний мочевого пузыря позволило В. С. Карпенко и О. П. Богатову (1981) и некоторым другим авторам во II стадию АПЖ ввести еще 3 подстадии. Первая из них характеризуется нарушением у части больных функции почек и уродинамики, вторая - пузырно-мочеточниково-лоханочными рефлюксами, III - выраженной декомпенсацией детрузора, сфинктеров мочевого пузыря при нарастающем снижении функции почек, нарушением водно-солевого обмена и КОС.
Спорным является вопрос, к какой стадии отнести больного с большой или гигантской АПЖ, но без остаточной мочи. Ведь это - опухоль, хотя и доброкачественная, и в любое время может наступить острая задержка мочи. Нам думается, что АПЖ у таких больных надо относить ко II стадии, что дает основание ставить показания к радикальной операции.
Осложнения. Почечная недостаточность. Хроническая задержка мочи, парадоксальная ишурия сопровождаются перерастяжением стенки мочевого пузыря, который превращается в большой тонкостенный шар.
Наступает соединительнотканное перерождение его стенки. Устья мочеточников зияют. Возникают пузырно-мочеточниково-лоханочные рефлюксы, что постепенно приводит к уретерогидронефрозу, чаще двустороннему. Гипертрофия и атрофия почечной паренхимы ведут к хронической почечной недостаточности. У больного появляются жажда, сухость ротовой полости, адинамия и другие ее признаки. Течение ее может носить интермиттирующий характер с активными фазами, одна из которых может перейти в декомпенсированную стадию.
Уретрит и цистит. Выраженная конгестия таза, распространяющаяся на мочевой пузырь, способствует возникновению воспалительного процесса в мочеиспускательном канале и мочевом пузыре. Прежде всего активизируется сапрофитная флора уретры. Катетеризации мочевого пузыря ведут к инфицированию этих органов. Появляются слизисто-гнойные выделения из уретры, рези в начале мочеиспускания, если оно еще возможно. Многое зависит от реакции организма и уретры на патогенную флору. У некоторых больных катетеризация длительное время проводится без осложнений, у других - выделения из уретры появляются спустя 1-2 сут. Особенно это может иметь место при так называемом постоянном катетере, удаление которого в сочетании с антибактериальной терапией и местным лечением может привести к быстрому выздоровлению. Неспецифическое воспаление мочевого пузыря обусловлено затруднением акта мочеиспускания, конгестией, снижением реактивности, особенно в старческом возрасте и при сахарном диабете. Этиологический фактор - патогенная бактериальная флора, чаще грамнегативная, которая может попасть в мочевой пузырь уже при первой катетеризации. Появляются катаральные и инфильтративные воспалительные изменения в слизистой оболочке мочевого пузыря, которая покрывается фибрином и слизью.
Выраженная дизурия, терминальная гематурия, боль над лобком - таковы обычные симптомы цистита. Однако гематурия при этом может быть и тотальной. Пальпация надлобковой области умеренно болезненна. Моча, если не окрашена кровью, мутноватая. Если имеется остаточная моча, лечить цистит при АПЖ сложно. Порой антибактериальное лечение, даже этиотропное, не помогает, так как оно проводится в условиях затрудненного оттока мочи. Иногда в связи с этим возникает вопрос об оперативном лечении - наложении эпицистостомы, хотя бы троакарной. Показания к радикальной операции - аденомэктомии - могут быть сужены. У некоторых больных цистит бывает настолько выраженным, что развивается микроцистис с перерождением стенки мочевого пузыря, с пузырно-мочеточниковооханочным рефлюксом, определяемым даже клинически - болью в почке во время акта мочеиспускания.
Эпидидимит, простатит, везикулит. Неспецифическое воспаление придатка яичка, реже - яичка, может наступить при гематогенном пути проникновения инфекции из регионарных предпузырных лимфоузлов при цистите и перицистите, при уретрите. Не менее частым является и каналикулярный путь: из задней уретры по короткому семявыбрасывающему протоку до места слияния семявыносящих протоков и протоков семенных пузырьков инфекция распространяется ретроградно. Возникают деферентит, эпидидимит. Увеличение придатка бывает равномерным. Как обруч, охватывает он несколько увеличенное яичко, образуя инфильтрат. У старых и ослабленных интеркуррентными заболеваниями больных, при сахарном диабете и хронической почечной недостаточности течение заболевания тяжелое, возможны абсцедирование и присоединение гнойного орхита. Придаток и яичко могут стать очагом уросепсиса. Если они вовремя не дренированы или не удалены гнойные очаги, не отведена моча, то возможен неблагоприятный исход.
Острого простатита при АПЖ обычно не бывает. Хронический простатит чаще предшествует возникновению АПЖ.
Прежняя концепция о том, что если есть простатит, то аденомы никогда не будет, не подтверждается. У больных АПЖ не всегда можно получить ее секрет. Течение простатита в начале обычное. С появлением аденомы пузырные симптомы, дизурия, странгурия начинают превалировать.
В. Г. Горюнов и Г. Е. Кузьмин (1984) наблюдали везикулиты при наличии АПЖ, в семенных пузырьках выявлялись и умеренное неспецифическое воспаление на фоне ретенционных изменений, и выраженный деструктивный процесс.
Острый и хронический пиелонефрит этиологически связан с наличием источников инфекции в нижних мочевых путях и в половых органах. При хронической или острой задержке мочи течение острого пиелонефрита отягощается. Вследствие нарушения оттока мочи и хронической почечной недостаточности возможен переход острого серозного воспаления в гнойное. Боль в поясничной области может и не усиливаться. Но явления интоксикации нарастают. Появляются потрясающие ознобы, хотя местная болезненность в области почек может отсутствовать. Парадоксальные явления особенно часты у старых и ослабленных мужчин, при сахарном диабете. При развившемся апостематозном нефрите, пока почка не дренирована, вследствие выхода в сосудистое русло патогенных бактерий может наступить бактериемический шок с критическим падением артериального давления и снижением диуреза.
Течение хронического пиелонефрита обычно без выраженных симптомов, может быть даже бессимптомным. Но это осложнение надо учитывать при решении вопроса об аденомэктомии, чтобы обеспечить адекватную антибактериальную терапию в послеоперационном периоде.
Камни мочевого пузыря усугубляют и осложняют течение АПЖ, но они не являются ее прямым следствием. В анамнезе таких больных можно выявить указания на почечные колики, отхождение камней. Затруднения мочеиспускания, стаз мочи являются предрасполагающим факторами. Нами были изучены причины камнеобразования при АПЖ [Тиктинский О. Л., 1980] и сделан вывод о том, что у большинства больных АПЖ образование конкрементов в мочевом пузыре является проявлением уролитиаза. Нарушение же оттока мочи вследствие аденомы - это патогенетическое, предрасполагающее к камнеобразованию условие.
Наличие камней в мочевом пузыре при АПЖ может не сопровождаться симптоматикой или симптомы этих двух заболеваний совпадают. Более выражена дизурия, возможны гематурия и боли над лобком, особенно после ходьбы, бега, тряской езды.
Гематурия. Объяснить возникновение гематурии при АПЖ можно разрывом небольшой вены в хирургической капсуле над аденомой. Но это бывает редко. Чаще гематурия связана с осложнениями - циститом, камнями мочевого пузыря, пиелонефритом (форникальное кровотечение). При этом не надо забывать и о возможном сочетании заболевания с опухолью мочевого пузыря. Характер гематурии - макроскопическая, изредка терминальная при цистите, чаще тотальная, с образованием бесформенных сгустков крови. Возможна тампонада мочевого пузыря.
Возникновение рака в АПЖ объясняется меняющимся гормональным фоном у пожилых мужчин. Появляющаяся со временем андрогения вместо эстрогении может служить канцерогенным фактором, фоном для которого является застой мочи и канцерогенных метаболитов, таких как триптофан.
Следует объяснить и возможность появления небольших аденоматозно- увеличенных периуретральных желез при склерозе предстательной железы (см. гл. 4). Это, однако, не является прецедентом для того, чтобы после простатэктомии по поводу склероза предстательной железы при обнаружении небольшой дольки аденомы ставить этот привычный уже диагноз. Это, кстати, и делают патологоанатомы, если они мало знакомы со склерозом предстательной железы. К сожалению, иногда "привычный" диагноз нужен для мнительного или конфликтного больного.
К осложнениям АПЖ порой относят и такие заболевания, как ишемическая болезнь сердца [Bruno A., Summers J., 1985, и др.]. Не меньше оснований имеется и для снижения копулятивной функции (репродуктивная может и не пострадать). И это не случайно, так как заболевание развивается на фоне гормональных нарушений. В. А. Козлов (1985) считает, что важную роль в процессе половых нарушений играют половая конституция больных, нарушение темпа пубертатного периода и несоответствие половой активности конституциональным данным.
Диагностика. Описанные выше симптомы, клиническое течение заболевания настолько характерны, что диагностика АПЖ, казалось бы, не должна вызывать каких-либо затруднений. Тем не менее симптомы, обусловленные затруднениями акта мочеиспускания, могут быть вызваны и другими заболеваниями - РПЖ, склерозом предстательной железы, простатитом, камнями мочевого пузыря, стриктурой уретры и др. Поставить диагноз АПЖ еще недостаточно. Важно установить стадию, анатомическую форму ее, осложнения. Необходимо выяснить функции почек, состояние других внутренних органов для решения вопроса о выборе тактики лечения и метода оперативного вмешательства. Это становится возможным после объективного исследования и проведения целого комплекса диагностических мероприятий.
Объективное исследование. Осмотр больных не выявляет каких-либо особенностей, кроме возрастных. Предположение о зависимости АПЖ и атеросклероза и о том, что она развивается обязательно у полных, ожиревших мужчин, не подтвердилось. Конституция, питание могут быть различными. Вторичных половых признаков, приближающихся к женскому типу, может не быть. И это понятно, гиперэстрогения наступает уже в пожилом или среднем возрасте. Но и явной волосистости лобка по мужскому типу (полоска волос по средней линии к лобку, остроконечность), что является признаком длительной андрогении, также не наблюдается.
Изменения в легких, сердце, печени чаще обусловлены сопутствующими заболеваниями. Почки обычно не прощупываются, но сотрясение поясничной области справа или слева, или с обеих сторон при наличии пиелонефрита болезненно. При острой или хронической задержке мочи определяется переполненный мочевой пузырь, который пальпируется и перкутируется.
При ректальной пальпации в самой ранней стадии заболевания может определяться несколько увеличенная краниальная часть предстательной железы. В последующем выявляется уже собственно аденома парауретральных желез. При этом чаще всего определяются 2 доли АПЖ (но не предстательной железы). Они могут быть умеренных или больших размеров до 5...6 X 8 см и более, округлой выпуклой формы, с гладкой поверхностью, гомогенной эластической или плотноэластической консистенции. Срединная бороздка обычно сглаживается. Слизистая оболочка прямой кишки подвижная. ПЖ может значительно пролабировать в просвет прямой кишки (ректальная форма). Неопределяемость ее при пальпации не исключает наличия пузырной формы ее, когда имеется средняя доля, нависающая над внутренним отверстием уретры и порой закрывающая его в виде клапана. Это выявляется специальными методами диагностики, которые будут описаны ниже. Чаще имеют место промежуточные между ректальной и пузырной формы.
Наличие плотных узлов, почти хрящевой консистенции, и, главное, расположение их на периферии предстательной железы, т. е. в каудальной части, которая находится под влиянием андрогенов, свидетельствуют о РПЖ. При II и III стадиях этого заболевания узлы опухоли становятся уже большими, занимают половину и более железы, еще более плотные и неподвижные. Но в этих стадиях РПЖ дифференцировать уже проще.
Отдельные узелки, но более мягкой консистенции, не прорастающие в капсулу, хотя и близко расположенные от нее, могут свидетельствовать о сопутствующем простатите. Мягкоэластические инфильтраты, чередующиеся с участками западения и размягчения каверны, определяются при туберкулезных поражениях. Камни предстательной железы пальпируются как плотные, иногда даже крепитирующие образования, окруженные у некоторых больных воспалительной капсулой. Склероз предстательной железы характеризуется уменьшением ее, плотной консистенцией, Рубцовыми деформациями.
Несмотря на значительную роль анамнеза и современных диагностических технических средств, пальпация предстательной железы имеет большое значение, так как в ней заключен личный опыт врача и это является первым впечатлением при обследовании больного. Попытки техническими средствами ректально точно определить размеры предстательной железы не нашли применения и теперь с появлением таких неинвазивных методов исследования, как УЗИ, вовсе потеряли смысл.
Лабораторное исследование имеет несколько направленностей. Оно сводится к выявлению воспалительных осложнений, признаков почечной и печеночной недостаточности, иммунологического статуса.
Клинические анализы крови и мочи при неосложненной АПЖ должны быть нормальными. У больных с выраженным циститом, пиелонефритом выявляются лейкоцитоз, сдвиг в лейкоцитарной формуле, увеличенная СОЭ. При хронической почечной недостаточности возможны снижения показателей гемоглобина, количества эритроцитов. Лейкоцитурии может не быть лишь в начале заболевания. Появление эритроцитов, в основном свежих, объясняется застойными явлениями (при варикозной болезни, камнях мочевого пузыря, цистите и пр.).
О нарушении суммарной функции почек свидетельствуют повышения уровня креатинина и мочевины в сыворотке крови. Более ранним признаком его является снижение способности почек концентрировать мочу. Нарушение функций печени, что может иметь место при хронической почечной недостаточности и некоторых сопутствующих заболеваниях, устанавливается определением в крови содержания белка в белковых фракциях, проведением пробы Квика - Пытеля, если нет задержки мочи и осложнения циститом (антитоксическая функция), определением общего, прямого и непрямого билирубина (пигментообразовательная функция), уровня аминотрансфераз, протромбина, холинэстеразы и др.
При сочетании АПЖ с простатитом получить секрет ее из-за сдавления собственно железы не удается. Отсутствие возможности у каждого больного с сочетанием АПЖ и простатита получить секрет ее для анализа дает основания для установления других лабораторных критериев. A. Marczynska и соавт. (1983), обследовав 42 больных АПЖ, выявили у них существенную гипоальбуминемию по сравнению со здоровыми лицами и в то же время гиперглобулинемию (α2, β, γ). Авторы установили также увеличение содержания в сыворотке крови иммуноглобулинов А, М и G. При очаговом простатите увеличение содержания иммуноглобулинов было чаще, чем у больных АПЖ, соответственно в 81% и 33% случаев. Нами обследованы 23 больных АПЖ, у которых удалось получить секрет предстательной железы и установить воспалительные изменения в нем. Повышенное содержание иммуноглобулинов А, М и G установлено в сыворотке крови 22 и 23 исследованных больных, что может служить диагностическим признаком простатита у больных АПЖ. Это особенно важно, если секрет ПЖ при массаже ее не поступает. Это же объясняется сдавлением выводных протоков ацинусов АПЖ.
Цистоскопия. Показания к инструментальным методам исследования, чрезвычайно инвазивным при нарушенном оттоке мочи при АПЖ, резко сужены. Цистоскопия показана при наличии гематурии, даже анамнестической, а также малейших неясностей, полученных при рентгеновском исследовании или УЗИ, указывающих на возможность сопутствующего новообразования мочевого пузыря. Проводить инструменты в мочевой пузырь необходимо чрезвычайно осторожно, чтобы не вызвать повреждений слизистой оболочки предстательной части уретры и тем более АПЖ. Последующий посттравматический отек может привести к острой задержке мочи.
Соблюдение правил асептики и антисептики при этом должно быть строжайшим. Иногда цистоскопию целесообразно проводить накануне планируемой операции.
Катетеризация мочевого пузыря для определения остаточной мочи должна быть сведена до минимума, учитывая возможности динамической сцинтиграфии и других современных неинвазивных методов.
Сфинктерометрия. В. С. Карпенко, О. П. Богатов (1981) описывают ее как весьма простой и доступный метод. Используется аппарат Рива-Роччи. Вместо манжеты присоединяется наконечник длиной 1-2 см, диаметром 0,5-0,7 см. После необходимой обработки его и наружного отверстия уретры наконечник вводится в мочеиспускательный канал на глубину 1,5-2 см. Прижатие резиновой муфтой дистального отдела полового члена обеспечивает герметичность. Баллоном сфигмоманометра в уретру медленно нагнетается воздух. Прослеживаются показания прибора, при резком их падении они фиксируются (в этот момент воздух преодолевает сопротивление сфинктеров). При АПЖ повышается уретральное сопротивление, а тонус сфинктеров снижен. Имеет значение и площадь поперечного сечения мочеиспускательного канала.
Цистоманометрия и радионуклидная урофлоуметрия характеризуют функции детрузора, мочеиспускательного канала и пузырно-уретрального сегмента. А. С. Портной (1979), проводя комплексное исследование, включающее урофлоуметрию, цистоманометрию и сфинктерометрию, установил снижение внутрипузырного давления в зависимости от стадии и периода АПЖ.
Рентгенологические методы исследования. Рентгенодиагностика начинается с обзорной рентгенографии почек и мочевых путей, рассчитанной на выявление контрастных конкрементов в проекции почек, мочеточников, мочевого пузыря и предстательной железы. Камни мочевого пузыря при АПЖ чаще всего неконтрастные (ураты), что не дает основания считать их "вторичными". Они являются следствием нарушенного синтеза мочевой кислоты, проявлением мочекислого уролитиаза, имевшего место еще до появления АПЖ, которая, несомненно, предрасполагает к камнеобразованию вследствие нарушения оттока мочи. Поэтому для выявления рентгенонеконтрастных камней нужны и другие методы. Среди них прицельная рентгенограмма проекции мочевого пузыря и пневмоцистография, которая производится с катетеризацией мочевого пузыря и введением в него 150-200 мл кислорода. На фоне газа обычно видны конкременты и дефект наполнения за счет АПЖ. Поэтому основное назначение этого исследования - это выявление АГ1Ж, ее размеров и конфигурации, что дает основание называть ее еще и простатографией. Однако дифференцировать таким образом АПЖ и РПЖ сложно. Для этого необходимы послойные рентгенограммы с различными фокусными расстояниями.
Пневмоцистотомография позволяет четко видеть структуру доброкачественной опухоли, дифференцировать ее от раковой. После подготовки кишечника производится катетеризация мочевого пузыря нелатоновским катетером. Вводится в среднем 150 мл кислорода. Проводится серия томограмм с различной высотой "среза", на которых выявляются такие рентгенологические признаки АПЖ, как приподнятость мочевого пузыря, равномерная умеренная асимметрия верхнего края предстательной железы при неодинаковых боковых долях, "симптом средней доли". Главным рентгенологическими симптомами являются гомогенность ПЖ на разных "срезах", расположение АПЖ в пределах капсулы. Пневмоцистотомография может быть настолько показательной, что исключает необходимость проведения компьютерной томографии.
Экскреторная внутривенная урография, нисходящая цистография. Назначение этого исследования двоякое: во-первых, как функциональной почечной пробы, позволяющей судить о раздельной функции почек. Во-вторых, это - морфологическое исследование чашек, лоханки и мочеточника, позволяющее судить о наличии сопутствующих заболеваний почек и об осложнениях - пиелонефрите, серозном или гнойном, уретерогидронефрозе и пр. Методика внутривенной урографии обычная, при несколько сниженной суммарной функции (умеренное повышение в сыворотке крови уровня мочевины и креатинина, незначительная изогипостенурия) целесообразно проводить инфузионную урографию. При АПЖ с острой задержкой мочи это исследование можно рассматривать как неотложное, но проводимое после получения информации о функции почек менее инвазивным методом. Несмотря на введение таких современных методов исследования, как УЗИ, радионуклидные исследования и др., значение экскреторной урографии нисколько не уменьшилось, информативность остается высокой. Примером могут служить данные S. Lapointe и соавт. (1984), охватывающие 500 больных АПЖ. Нормальные данные экскреторной урографии были только у 374 больных АПЖ, патологические изменения почек и мочеточников установлены в 26,2% наблюдений. При этом установлены аномалии положения, формы и количества почек, мочеточников у 4,8%, губчатая почка - у 0,2%, синусоидальный липоматоз (педункулит) - у 2,8%, вторичный гидронефроз - у 5,4%, почечные конкременты - у 2,6%, хронический пиелонефр ит - у 1,4 опухоль почки - у 0,2% и т. д. Анализ экскреторных урограмм больных АПЖ по материалам одной из клиник нашей кафедры (412 наблюдений, только плановые больные) свидетельствует о меньшей частоте аномалий развития почек и мочеточников. Они составили всего лишь 2,2% наблюдений, В основном рентгенологические изменения касались рентгенологической картины пиелонефрита (сужение шеек чашек, их треугольная конфигурация, колбовидное расширение, уплощение сводов, ампулярная форма лоханок, лоханочно-почечные рефлюксы, симптом Ходсона, начальная фаза вторичного сморщивания). У 12,8% больных выявлены в различной степени выраженные уретеропиелоэктазии, почти у половины больных - двусторонние. Только у 0,7% был настоящий вторичный гидронефроз. Другие изменения установлены еще в 1,2% наблюдений. Патологические изменения в почках и нижних мочевых путях, таким образом, выявлены у 26,9% больных. К уретеропиелоэктазиям мы относим расширения и изогнутость юкставезикального отдела мочеточника (так называемый "симптом крючка"), которые наблюдаются при сдавлении его АПЖ.
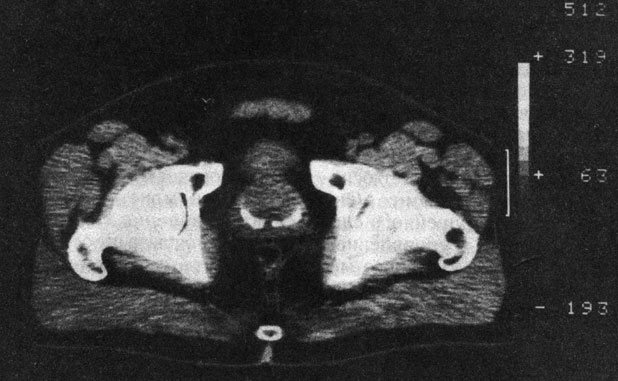
Рис. 39. Компьютерная рентгенограмма АПЖ многоузловатой конфигурации
Компьютерная томография отчетливо выявляет не только размеры, но и контуры АПЖ, границы, а также гомогенность структуры, что позволяет отчетливо дифференцировать ее от РПЖ (рис. 39). Распространение опухоли, локализация узлов в каудальной, т. е. периферической, части предстательной железы, ближе к капсуле позволяет дифференцировать РПЖ от АПЖ.
D. Rickards и соавт. (1983) считают, что компьютерная томограмма более информативна, чем трансректальное УЗИ.
Ультразвуковое сканирование предстательной железы. Основными ультрасонографическими критериями АПЖ являются ее размеры, конфигурация, гомогенность и консистенция, отношение к капсуле. Отсутствие инвазивности и возможность дифференцирования от других заболеваний (РПЖ и ее склероз, простатит) ставят этот метод в одно из первых мест в диагностике данного заболевания.
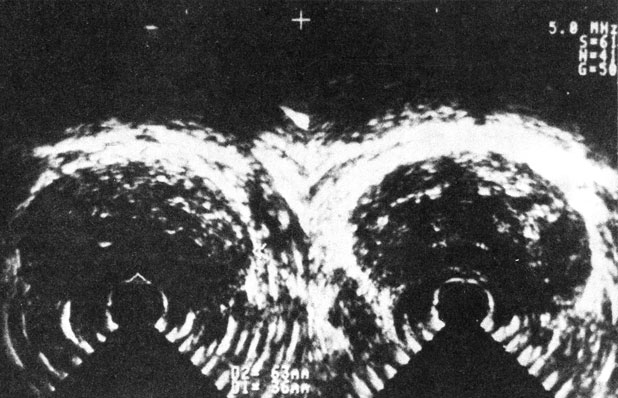
Рис. 40. Трансректальная горизонтальная ультрасонотомограмма аденомы предстательной железы.
Обоснованием клинического применения УЗИ послужили фундаментальные эхоморфологические работы ряда авторов [Peneau М. et al., 1985; Frentzei-Beyme В., Ledwa D., 1986; Pencert A., Ristan U., 1986, и др.]. Авторы установили корреляцию результатов морфологических исследований и ультразвуковых признаков АПЖ, используя биопсийный и секционный материал.
А. Ф. Цыб и соавт. (1987) и др. отмечают, что предстательная железа в норме имеет форму неправильного треугольника с соотношением основания и высоты 5 : 3, с четкими контурами, эхооднородную, имеющую мелкогранулярную структуру. Капсула железы повышенной эхоплотности четко разграничена с клеточным пространством перед стенкой прямой кишки шириной в 4-5 мм, пониженной эхоплотности. Для АПЖ характерны большие размеры, овальная форма, симметричность, иногда намечающийся внутрипузырный узел, однородная внутренняя эхоструктура. Капсула - четко определяемая, гладкая (рис. 40), что отличает ее от прерывистой линии при РПЖ III-IV стадий. При этом отмечается неоднородная эхоструктура, что, однако, может иметь место и при диффузной гиперплазии предстательной железы [Frentzei-Beyme В., Ledwa D., 1986]. При дифференцировании АПЖ и РПЖ следует учитывать характерную локализацию неоднородных эхоструктур при раке в каудальной зоне и возможность их обнаружения за пределами капсулы. При хроническом простатите выявляются симметричные гиперэхогенные очаги. Камни предстательной железы характеризуются интенсивными, локально ограниченными, эхологически плотными участками, иногда с акустической тенью.
В последнее время с появлением ультразвуковых аппаратов второго поколения нашли применение 4 методики ультразвуковой визуализации: надлобковая, поперечная трансуретральная, поперечная и продольная трансректальная. Сторонники трансректального УЗИ [Fritzsche P. et al., 1983; Burks D. et al., 1986; Wiegand S., Weidner W., 1986, и др.] объясняют это увеличивающимися возможностями дифференциальной диагностики с РПЖ, простатитом и др. Однако это несколько уменьшает неинвазивность метода, так как требует подготовки кишечника и навыков введения ректального датчика в сигмовидную кишку [Okafor P. et al., 1983]. В то же время улучшившиеся технические возможности увеличили информативность совершенно неинвазивных методик. P. Walz и соавт. (1983), О. Utzmann и соавт. (1985), G. Galdellin и соавт. (1986), W. Hubrich (1986) придают большое значение надлобковому доступу при проведении УЗИ. Наши наблюдения дают основание считать, что надлобковое УЗИ является вполне информативным при АПЖ, если не возникает необходимость проведения дифференциальной диагностики с другими заболеваниями, особенно РПЖ. УЗИ являются также необходимыми при проведении чрескутанных эндовезикальных операций при заболеваниях, обусловленных АПЖ для динамического контроля.
Радионуклидные исследования. К диагностике АПЖ они не имеют прямого отношения. Радионуклидные методы выявляют функциональные проявления и осложнения этого заболевания, что позволяет судить о степени и стадии заболевания. Однако нарушения мочеотделения и мочевыведения могут быть не только при АПЖ, но и при РПЖ и ее склерозе, при хроническом простатите, хотя в большей степени они все же характерны для АПЖ.
Нарушенный синтез цинка при этом заболевании, относительно большое скопление его в предстательной железе привели к попыткам проведения сцинтиграфии ее с нуклидами 65Zn и 69Zn [Okada К. et al" 1983; Kavanagh J. et al., 1983], что могло бы стать дифференциально диагностическим критерием между АПЖ, РПЖ и другими заболеваниями этого органа. Однако практического применения настоящая методика не получила.
Радионуклидная ренография, проводимая с 131I-гиппураном, позволяет выявить очень незначительные нарушения функции извитых почечных канальцев. Графики кривых, получаемые раздельно для обеих почек, создают представление о секреторной функции канальцев, о чем свидетельствует снижение секреторного сегмента, что характерно для ранних пиелонефритических проявлений. Но для АПЖ с обструкцией на уровне пузырного сегмента, при уретероэктазии патогномонично нарушение экскреторного сегмента. Регистрация кривой клиренса (3-я кривая на ренограмме) позволяет судить о величине почечного кровотока и клубочковой фильтрации. В. С. Карпенко и О. П. Богатов (1981) считают, что при отсутствии нарушений сосудистого, секреторного и экскреторного сегментов и показателей Винтера 50-55% следует предполагать I стадию заболевания. При одно- или двусторонних нарушениях секреторного или экскреторного сегментов и показателя Винтера выше 55% имеются данные о II стадии аденомы, если, конечно, этот диагноз уже поставлен на основании проведенных других методов исследования. О III стадии заболевания только по данным ренографии можно судить при выраженных нарушениях секреции и экскреции обеих почек.
Сканирование почек, проводимое с l97Hg-нeoгидpинoм и 203Нg-неогидрином, которые медленно накапливаются в сохраненных эпителиальных клетках проксимальных почечных канальцев, выявляют участки нефункционирующей почечной паренхимы, не поглощающие нуклиды.
Нарушения уродинамики, что очень важно при этом заболевании, выявляются динамической сцинтиграфией с 1311-гиппураном или 251-гиппураном в виде серии сцинтиграмм, получаемых на гамма-камере. Появление контрастирующего вещества при этом исследовании фиксируется уже на 2-5-й минутах после введения. Отчетливо определяется оно в расширенных полостях почек и в мочеточниках. Статическая сцинтиграфия дополняет динамическую, выявляя участки поражения почечной паренхимы. С помощью сцинтиграфии выявляются нарушения уродинамики, возникшие вследствие обструкции в пузырном сегменте, и пиелонефритические поражения в почках, которые носят очаговый характер.
Радионуклидная урофлоуметрия проводится через 1-2 ч после радионуклидной ренографии или реносцинтиграфии. Сцинтиляционным счетчиком, расположенным над областью мочевого пузыря, фиксируются скорость поступления в него I-гиппурана и динамика радиоактивности при мочеиспускании. Показателями являются время мочеиспускания, объем выделенной мочи и урофлоуметрический индекс. Последний рассчитывается по соотношению объема выделенной мочи и урофлоуметрического индекса, который определяется соотношением объема выделенной мочи и времени мочеиспускания. АПЖ характеризуется снижением урофлоуметрического индекса и повышением уретрального сопротивления. А. С. Портной (1979) выявлял таким образом и пузырно-мочеточниковые рефлюксы.
Остаточная моча определяется при сцинтиграфии и методом радионуклидной урофлоуметрии, что позволяет судить о выраженности проявлений болезни, о стадии заболевания.
К второстепенным методам исследования относятся ядерно-магнитно-резонансная томография, термография, биопсия предстательной железы и др.
Термографически АПЖ и РПЖ различаются по характерному для злокачественной опухоли свечению и по пораженным метастазами регионарным лимфоузлам. При сопутствующем цистите с помощью термографии выявляется воспалительное свечение мочевого пузыря.
Показания для биопсии при АПЖ весьма ограниченны. Только наличие воспалительных узлов, участков обызвествления в аденоме, что надо отличать от РПЖ, может стать основанием для проведения этого инвазивного исследования.
Дифференциальная диагностика проводится с раком и склерозом предстательной железы, хроническим простатитом, опухолью и камнями мочевого пузыря и другими заболеваниями, что описано при объективном исследовании и в соответствующих разделах диагностики.
Консервативное лечение. Радикальных методов консервативного лечения АПЖ не существует. В то же время степень риска оперативных вмешательств при этом заболевании, несмотря на развитие хирургии и анестезиологии, остается довольно высокой, что обусловлено пожилым и старческим возрастом больных, анатомическими особенностями органа и др. Возможность "лечения без операции" привлекает внимание больных и заставляет задуматься и врачей, тем более, что известно благополучное бессимптомное течение ректальной формы АПЖ. Для некоторых больных диагноз этого заболевания является настолько неожиданным, что консервативное лечение порой назначается и в качестве психологической подготовки к возможной операции.
Консервативное лечение показано при АПЖ I стадии, т. е. при отсутствии остаточной мочи или у больных с сопутствующими заболеваниями, при которых аденомэктомия противопоказана. На неоперативное лечение может претендовать любой больной с II стадией заболевания, отказавшийся от операции или при наличии очень веских противопоказаний.
Гормональная терапия занимает ведущее место среди консервативных методов. В основном она сводится к назначению половых гормонов, женских или мужских. Она начиналась с применения эстрогенов. А. Б. Топчан и А. А. Померанцев (1949) добились широкого применения синэстрола в связи с его тонизирующим эффектом на детрузор. Однако вскоре наступило разочарование; эстрогены не уменьшали АПЖ, соединительнотканному замещению подвергаются железистые элементы собственно предстательной железы за счет разрастания стромы, что затрудняет в последующем аденомэктомию. Появилась другая, противоположная тенденция - назначение андрогенов [Фрумкин А. П., 1956, и др.]. Патогенетически это более объяснимо. Нарушение баланса половых гормонов в сторону эстрогенов объясняет назначение андрогенов, что также улучшает мочеиспускание и подтверждается данными урофлоуметрии. Андрогенные препараты имеют широкое распространение и в настоящее время. Метилтестостерон назначается по 5 мг в таблетках под язык 3 раза в сутки в течение 30-60 дней. Тестобромлецит - таким же образом. Курсы лечения повторяют. Возможно пролонгированное введение андрогенов - сустанона, омнодрена, тестостерона энантата, который вводится в 20% растворе по 0,5 мл внутримышечно через 3-4 нед, всего 2-3 раза. Применяется и 5% масляный раствор тестостерона пропионата по 1 мл (50 мг) внутримышечно 2-3 раза в неделю, всего 6-8 инъекций.
В связи с обнаружением в АПЖ метаболитов тестостерона - 5α-дигидротестостерона, которого в ней больше, чем в нормальной железе в 5 раз, изменилось отношение к андрогенам в патогенезе этого заболевания [Портной А. С., 1979; Tan S., 1974]. Появилось понятие о периферийных андрогенах ai-адренорецепторах, что привело к трем направлениям в медикаментозной гормональной терапии. Прежде всего это создание комбинированных препаратов, содержащих и андрогены, и эстрогены (тестобромэстрол и др.). Другое направление - назначение препаратов, механизм действия которых включает снижение функционального состояния системы гипоталамус - аденогипофиз - гландулоциты яичка, результатом чего являются угнетение выделения ЛГ, нарушение метаболизма андрогенов в предстательной железе. К этим препаратам относятся гестагены. Прогестерон вводится в виде 1% масляного раствора по 2 мл внутримышечно 3 раза в неделю в течение месяца. Оксипрогестерона капронат назначается в виде 12,5% масляного раствора по 1 мл внутримышечно 3 раза в неделю в течение 2 мес. Прегнин рекомендуется по 1 таблетке (0,01 г) 3 раза в день в течение 2 мес. Затем дозы препаратов значительно уменьшают. Возможно назначение и зарубежных аналогов - депостата, андрокура, SCH13521 и др. Более непосредственное блокирование периферийных андрогенов - андренорецепторов - осуществляется такими препаратами, как прозосин [Hedlund Н., Anderson К.-Е., 1983], α-блокатор [Bouffioux С., Penders L., 1984], бифлуранол [Beacock С. et al., 1985] , феноксибензамин [Caine М., 1986] и др. Н. Poppel и соавт. (1987) применяют ингибитор пролактина бромокриптин по 7,5 мг/сут. В последнее время назначается трианол.
Клинический эффект (уменьшение поллакиурии, никтурии) получен в нашей стране при назначении полиенового антибиотика леворина, уменьшающего, кроме того, в эксперименте собственно предстательную железу у животных [Ключарев Б. В. и др., 1973; Куликов С. К., 1981]. Леворин назначается по 500000 ЕД 2 раза в день в течение 2 нед, затем 3 раза в течение 3 нед и 4 дня в течение 6 нед. A. Durval и соавт. (1986) сообщают о новом полиеновом макролиде - мепартрицине, который уменьшил поллакиурию у 80%, никтурию у 81,2%, дизурию - у 61,5% больных. Побочные явления незначительны.
Раверон, являющийся экстрактом предстательных желез крупного рогатого скота, оказывает противовоспалительное и незначительно тормозящее действие на пролиферацию краниального отдела предстательной железы и парауретральные железы, несколько тонизирует детрузор. Эффективен при АПЖ I стадии в сочетании с простатитом. Назначается по 1 мл ежедневно или по 2 мл через день в течение месяца.
В последние годы нашел применение таблетированный препарат робаверон, являющийся экстрактом предстательной железы свиньи. Назначается по 2 таблетки (20 мг экстракта в каждой) 6 раз в день в течение 3 нед.
Применяются и препараты растительного происхождения. Среди них РА-109, или пермиксон, - экстракт карликовой американской пальмы Serenoa repens [Tasca A. et al., 1985]. Более известен таденан, представляющий собою экстракт из растения Pugeum africanum Bassi P. et al., 1987]. В медикаментозном лечении АПЖ, ее симптомов содержится и психологический компонент. В акте мочеиспускания участвуют и условнорефлекторные связи. Поэтому сам факт лечения уже может давать эффект. Плацебо (ничто), или "пустышка", используется в исследованиях зарубежных авторов для сравнения с действием какого-либо препарата при так называемом слепом исследовании. Иногда плацебо дает эффект. Н. Smith и соавт. (1986), изучая методом двойного слепого контроля действие на АПЖ пермиксона, получили одинаковый с ним эффект и от плацебо, объясняя это популярностью препарата. Аналогичные наблюдения проведены нами с равероном, причем это было в период его наибольшей популярности среди пациентов.
Среди лечебных мероприятий значительное место занимает режим больного. Прежде всего это абсолютное исключение алкоголя. Прием даже 20-30 г спиртных напитков вызывает конгестию - прилив крови к тазовым органам, к предстательной железе, в подслизистый слой предстательной части уретры, что может привести к острой задержке мочи. Это же могут вызвать и погрешности в диете (прием острой пищи), половые эксцессы, малая физическая активность. В связи с этим В. В. Мазин и соавт. (1985) рекомендуют специальный комплекс лечебной гимнастики для больных с АПЖ. В этом во многом заключается и профилактика АПЖ. Дизритмия половой жизни весьма нежелательна. Половая жизнь должна быть умеренно активной, ритмичной.
Хирургическое лечение. При раскопках Помпеи, засыпанной пеплом при извержении Везувия в 69 г. н. э., обнаружены металлические катетеры. В некоторых древних папирусах сохранились описания катетеризации мочевого пузыря, которая проводилась не только у больных с камнями мочевого пузыря и уретры, но и при АПЖ. Известный в средневековье камнесек отец Якоб при острой задержке мочи пользовался созданной им острой платиновой канюлей для промежностной пункции мочевого пузыря, которую он пришивал к коже промежности.
В 1934 г. Gutrie и Amussat, независимо друг от друга удалили АПЖ. В последующем эта операция в чреспузырном варианте была разработана Fuller (1895), Freyer (1896), С. П. Федоровым (1898, 1908). Провозглашенная в свое время тактика в лечении АПЖ остается ведущей до настоящего времени, но претерпела ряд изменений.
Особенности хирургической тактики у больных АПЖ при острой задержке мочи. При этом возникает вопрос о срочном оперативном лечении и прежде всего - о неотложной аденомэктомии.
Неотложную аденомэктомию условно подразделяют на экстренную, проводимую в первые 6 ч после задержки мочи, и срочную, когда операция откладывается на 6-24 ч [Карпенко В. С., Богатое О. П., 1981].
Экстренная аденомэктомия предполагает полное исключение катетеризации мочевого пузыря на предыдущих этапах и в стационаре, что резко ограничивает возможность инфицирования собственной бактериальной флорой уретры и вследствие госпитализма. По данным О. Л. Тиктинского (1988), отмечается явное преобладание числа произведенных срочных аденомэктомий над экстренными; на 373 неотложных аденомэктомий, проведенных за последние 5 лет в клиниках урологии ЛенГИДУВа, приходится только 52 экстренных (и 321 срочных аденомэктомий). У 268 из 373 больных при этом произведена операция с глухим швом.
Перед проведением срочной аденомэктомии В. С. Карпенко и О. П. Богатое (1981) допускают осторожную катетеризацию с тщательным соблюдением асептики и антисептики. Тактика и методика срочной аденомэктомии нами изменены для части больных. Если произвести экстренную аденомэктомию не удается, так как далеко не всегда можно обследовать больного за 6 ч, то вместо катетеризации мочевого пузыря производится временная капиллярная троакарная эпицистостомия с использованием анестезиологического набора. При этом мочу берут для бактериологического посева и общего анализа. Помимо исследования крови на мочевину, креатинин или средние молекулы, протромбин и другие показатели свертывающей системы, на сахар, белки, производятся электрокардиография, обзорная рентгенограмма почек и мочевых путей, внутривенная урография с нисходящей цистографией. Временное отведение мочи дает возможность произвести срочную аденомэктомию в первые 36 ч и начать антибактериальную терапию, а при необходимости и введение других медикаментозных средств. Это позволяет расширить объем неотложного обследования, включив в него нефросцинтиграфию или радионуклидную ренографию и некоторые другие исследования. При необходимости можно осуществить консультацию не только дежурного терапевта, но и кардиолога. Аденомэктомия, как правило, производится с наложением глухого шва с постоянным орошением, с гидростатическим гемостазом.
Противопоказаниями к экстренной аденомэктомии являются острый пиелонефрит, особенно двусторонний, сердечно-сосудистая, сердечно-легочная и печеночная недостаточность, некомпенсированный сахарный диабет и активный туберкулез легких, аллергия, нарушения свертываемости крови, сенильный и алкогольный психозы, старческий маразм, а также выявленные при обследовании такие заболевания мочевого пузыря, как опухоли и дивертикулы, подозрение на рак в аденоме. Желателен более молодой возраст - не более 60-65 лет, но не исключаются и лица более старшего возраста - многое зависит от сохранности и сопутствующих заболеваний.
Для срочной аденомэктомии противопоказания в общем такие же, но они несколько сужены. При остром пиелонефрите, даже двустороннем, если нет перехода серозного воспаления в гнойное, надо решить вопрос, не обусловлено ли оно сдавлением аденомой интрамуральной части мочеточников, что выявляется на внутривенных урограммах в виде расширения и изогнутости юкставезикальных отделов. При обусловленности пиелонефрита обструкцией мочеточников аденомой срочная аденомэктомия не противопоказана. Умеренное повышение уровня мочевины сыворотки крови до 10 ммоль/л, креатинина до 0,17-0,18 ммоль/л при достаточно высокой относительной плотности мочи, при хорошем общем состоянии больного и отсутствии в анамнезе признаков ХПН не может быть препятствием к срочной аденомэктомии. Таким больным целесообразно введение ретаболила перед операцией или в первые 1-2 дня после вмешательства, а также переливание 3% раствора натрия гидрокарбоната, леспенефрила и др.
Сердечно-сосудистая и сердечно-легочная недостаточность I степени может быть реакцией на острую задержку мочи. Интенсивная терапия, проводимая в предоперационном периоде, во время операции и в первые дни после нее надежно предохраняет от усугубления этих осложнений. Капиллярная троакарная эпицистостомия, которую мы не считаем самостоятельной операцией, входит в предоперационную подготовку, спустя 10-18 ч снимает эти явления и без интенсивной терапии, приводит к нормализации водно-электролитного баланса, незначительные сдвиги которого нам удалось уловить менее чем у 1/3 больных. Такая тактика расширяет диапазон проведения срочной аденомэктомии, так как имеется возможность изучить больного и лучше подготовить к операции.
Инфекция мочевых путей, пиелонефрит при многократных катетеризациях могут привести к уросепсису, к апостематозному пиелонефриту. Длительная катетеризация больных с острой задержкой мочи при АПЖ недопустима. При плохой организации урологической службы, к сожалению, это имеет место. Чаще больных катетеризуют в связи с отказом от операции, что объясняется низким уровнем санитарно-просветительной работы среди населения. Катетеризация больных в течение 3-4 дней и более приводит к инфицированности больных и исключает срочную аденомэктомию даже при отсутствии противопоказаний к ней. В таких ситуациях применяется предложенная нами тактика отсроченной аденомэктомии [Тиктинский О. Л. и др., 1973], которая проводится уже многими урологами. При поступлении производится обычная троакарная эпицистостомия, спустя 6-10 дней - отсроченная аденомэктомия. В промежутке между двумя операциями проводятся антибактериальная и противовоспалительная терапия, клиническое и урологическое обследование.
При противопоказаниях к неотложной и отсроченной аденомэктомии возникает вопрос и о высоком сечении мочевого пузыря. Периодическая катетеризация не должна быть длительной. Через 1-2 дня больному следует отводить мочу, рассматривая эту операцию как проводимую по жизненным показаниям, а не как начало двухэтапного оперативного лечения, предложенного Б. Н. Хольцовым (1908).
Показания к плановой аденомэктомии. Решение вопроса об оперативном лечении больных АПЖ в "холодном периоде" заболевания является не менее ответственным, чем выбор тактики при остром течении его. Для больных АПЖ во II стадии вопрос решается однозначно, при этом показана аденомэктомия. При отсутствии остаточной мочи, т. е. в I стадии заболевания, расстройства мочеиспускания бывают минимальными, а аденома может достигать огромных размеров и даже быть не ректального, а пузырного типа. Мы рассматриваем это как II стадию заболевания. В целом таких больных надо оперировать, но с учетом возраста и сопутствующих заболеваний. При тяжелой степени сердечно-сосудистой, сердечно-легочной недостаточности, при сахарном диабете и некоторых серьезных сопутствующих заболеваниях и осложнениях требуется предварительная медикаментозная подготовка.
Двухэтапная аденомэктомия в настоящее время в сочетании с современной предоперационной подготовкой, операционным и послеоперационным обеспечением одномоментной аденомэктомии не уменьшает степени операционного риска. Это касается больных с обструкцией нижних отделов мочеточников вследствие сдавления аденомой. Это не снижает исторической значимости двухэтапной аденомэктомии по Хольцову, которая в начале столетия спасла жизнь многим тысячам больных. Показанием к операции Хольцова в настоящее время может быть выраженная атония мочевого пузыря с наличием парадоксальной ишурии.
Выбор способа операции во многом зависит от размеров АПЖ. Проведение ТУР целесообразно при АПЖ до 50 г, лучше плотной консистенции и обязательно пузырного типа. При больших АПЖ у больных без избыточного питания, особенно астенического телосложения, показана позадилобковая аденомэктомия. По мере нарастания оперативного опыта уролога показания к позадилобковой аденомэктомии увеличиваются. Показания к чреспузырной аденомэктомии связывают с необходимостью ревизии полости мочевого пузыря при подозрении на сопутствующую опухоль, камни, при дивертикулах, у больных с мочепузырными свищами, при варикозной болезни.
Преимущества ТУР, включающие меньшую травматичность и психологические положительные аспекты, несколько снижаются вследствие более значительных операционных и послеоперационных кровотечений, что представлено на нашем материале А. Н. Берковичем и Э. С. Зеленчонком (1988). Показания к ТУР зависят и от оперативной техники уролога и от уровня технической оснащенности [Новиков И. Ф., 1988]. Проведение ТУР осуществляется под перидуральной анестезией и инфузионным прикрытием.
Особенности оперативной техники. Чреспузырная аденомэктомия, так называемая открытая операция Фуллера - Фрейера - Федорова, производится в основном с тампонадой ложа предстательной железы; она подробно описана в руководствах и монографиях.
В настоящее время методом выбора является одномоментная аденомэктомия с глухим швом, называемая прежде расширенной, или идеальной, операция Гарриса - Гринчака. Техника ее известна, различаются методы ушивания ложа АПЖ. Однако все способы ушивания ложа, хирургической капсулы могут привести к рубцовому стенозу шейки мочевого пузыря, образованию предпузыря.
На смену им пришли методы гемостаза путем наложения съемных швов на ложе предстательной железы. Среди них способ V. Szabo и соавт. (1970, 1976). При этом съемный кисетный шов выводится на переднюю брюшную стенку с умеренным натяжением. В 1973 г. наш опыт в проведении операции Сабо с некоторой модификацией включал 59 наблюдений с удовлетворительными результатами [Тиктинский О. Л. и др., 1973]. Но со временем пришлось убедиться в том, что выведение съемного шва на брюшную стенку вызывает деформацию ложа и образование предпузыря. Это и привело к созданию другого способа гемостаза, ликвидирующего полость, образующуюся после удаления аденомы.
И. Ф. Новиковым (1974, 1985) предложен способ аденомэктомии со съемным нейлоновым швом, выводимым на промежность. Он заключается в следующем (рис. 41). Из срединного разреза над лобком вскрывают мочевой пузырь. Затем обычной хирургической иглой производят предварительное прошивание и лигирование кетгутом верхних и нижних сосудов предстательной железы. Разрез слизистой оболочки мочевого пузыря производят вокруг внутреннего отверстия мочеиспускательного канала в виде треугольника, основание которого направлено кверху, а верхушка - книзу. АПЖ вылущивают обычным бимануальным способом. Затем тампонируют и временно прижимают кровоточащие сосуды ложа предстательной железы тампоном, смоченным 3% раствором перекиси водорода или ε-аминокапроновой кислоты. Затем удаляют тампон и антеградно проводят 2 полиэтиленовых дренажа через просвет уретры. Накладывают кисетный нейлоновый или капроновый шов на хирургическую капсулу из нижнеправого угла раны вокруг дренажной трубки по часовой стрелке. Затем нити натягивают и с помощью сконструированных нами игл выводят параллельно задней части уретры на промежность. После затягивания кисетного шва нити завязывают на марлевом тампоне на промежности. Мочевой пузырь и рану ушивают наглухо. Через 6 ч после операции нить развязывают, и если кровотечение не возобновляется, то удаляют через 2 дня.
![Рис. 41. Аденомэктомия с глухим швом с выведением лигатуры на промежность [Новиков И. Ф., 1974]. а - прошивание и лигирование верхних и нижних предстательных артерий; б - после удаления аденомы наложен кисетный капроновый шов, введены 2 дренажные трубки; в - вид кисетного шва сбоку; г - кисетный шов затянут, хирургическая капсула ввернулась внутрь; д - концы нитей выведены параллельно на промежность; е - нити завязаны на тампоне](pic/000050.jpg)
Рис. 41. Аденомэктомия с глухим швом с выведением лигатуры на промежность [Новиков И. Ф., 1974]. а - прошивание и лигирование верхних и нижних предстательных артерий; б - после удаления аденомы наложен кисетный капроновый шов, введены 2 дренажные трубки; в - вид кисетного шва сбоку; г - кисетный шов затянут, хирургическая капсула ввернулась внутрь; д - концы нитей выведены параллельно на промежность; е - нити завязаны на тампоне
При появлении геморрагии кисетный шов снова затягивают и оставляют наложенным еще на сутки.
Ряд авторов предлагают выведение съемных швов через уретру [Тельфер П. И. и др., 1959; Ситдыков Э. Н., 1964] с созданием натяжения на сутки. Ю. А. Пытель и др. (1973) применили съемные гемостатические швы с прошиванием области треугольника между межмочеточниковой складкой и внутренним отверстием уретры и с выведением их через уретру с вытяжением на 5-6 ч. Н. Ф. Сергиенко (1979) предложена экстрауретральная аденомэктомия, цель которой - сохранить предстательную часть уретры.
В последние годы получил распространение менее травматичный способ аденомэктомии, основанный на физиологическом сокращении ложа предстательной железы и создании гидростатического гемостаза путем постоянного орошения мочевого пузыря антисептическими растворами. Тампонада ложа АПЖ марлевым тампоном проводится временно в течение 10-15 мин или менее того. Затем в уретру и мочевой пузырь вводят 2 полихлорвиниловые трубки одинакового сечения, внутренние концы фиксируют съемным лавсановым швом, проводимым через боковую стенку мочевого пузыря на кожу брюшной стенки, где фиксируют на 6-7 дней. Орошение 0,9% раствором натрия хлорида или фурацилина 1:3 000 начинается уже в операционной в момент завязывания кисетного шва, наложенного вокруг раны мочевого пузыря. Это является непременным условием метода. Орошение проводится непрерывно в течение 6-7 дней.
Другим хирургическим нюансом является способ малотравматичного проведения 2 полихлорвиниловых трубок через уретру в мочевой пузырь. Для этого концы уретральных трубок, через которые не проведен лавсановый шов, вводятся вовнутрь короткой резиновой трубки. Свободный конец ее надевается на металлический буж, введенный после удаления АПЖ через уретру в мочевой пузырь. Затем ретроградно с бужом резиновая трубка с полихлорвиниловыми вводится в мочевой пузырь через рану его и выводится через уретру (рис. 42).
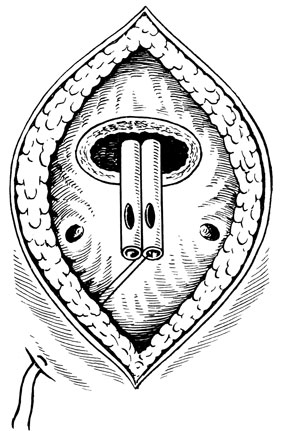
Рис. 42. Фрагмент аденомэктомии с глухим швом без ушивания ложа предстательной железы. Через дистальные концы уретральных дренажных трубок шелковая нить проведена через боковую стенку мочевого пузыря и выведена временно на брюшную стенку
Принцип метода был предложен С. Т. Биляком (1980), но автор создавал в мочевом пузыре повышенное давление ввиду большего диаметра уретрального приводящего дренажа, что являлось недостатком этой методики, в последующем стали пользоваться трубками одинакового диаметра. По методике бесшовного ведения ложа АПЖ (она является основной) в клиниках нашей кафедры с 1980 г. произведено 1037 операций, в числе которых было 19,6% ургентных. В. Н. Ткачуком и соавт. (1985) по этой методике произведено 1252 аденомэктомии, из которых 18,8% - ургентные. Койкодень при этом, по нашим данным и этих авторов, составил соответственно 14,3 ± 1,6 и 12,6 ± 0,7; послеоперационная летальность - 1,88 и 1,27%. Объясняется это меньшей травматичностью и эффектом постоянного вымывания из ложа АПЖ фибринолитических веществ.
Методика позадилобковой аденомэктомии по Лидскому - Миллину. Больного укладывают на операционный стол в положении Тренделенбурга. Анестезия перидуральная или интратрахеальный наркоз. В операции участвует дополнительный ассистент, который ректально-пальцевым приемом в нужные моменты приближает АПЖ к операционной ране. Разрез брюшной стенки над лобком - поперечный. Доступ к АПЖ позадилобковый, внепузырный (рис. 43, а). На соединительнотканную общую оболочку предстательной железы под мочевым пузырем накладывают двухрядные обкалывающие кетгутовые швы, которые завязывают, но оставляют как длинные держалки (рис. 43,6). При этом лигируются проходящие на соединительной капсуле предпузырные вены, которые иногда, особенно при варикозной болезни, бывают большого размера. Между двумя рядами швов, верхними и нижними, после перемещения ректальным ассистентом АПЖ в рану, соединительную капсулу поперечно и полулунно вскрывают (рис. 43, в). Доли аденомы вылущивают. При этом на одну из них накладывают щипцы Мюзе. Предстательную часть уретры пересекают. При применении тактики сохранения уретры, что довольно сложно сделать, мы применяем специальный инструмент-щипцы, напоминающие 2 векоподъемника, "смотрящие" внутрь "друг на друга", вводимые между аденомой и уретрой. После этого одну из долей ее пересекают, уретру марлевым тупфером осторожно от нее отделяют, а разъединенную АПЖ полностью вылущивают и удаляют. При этом чаще происходит небольшой надрыв уретры, который на введенном в нее еще до операции катетере Фолея ушивается. Такая тактика позадилобковой аденомэктомии с сохранением уретры носит несколько слепой характер. При этом до операции необходимо тщательно исследовать мочевой пузырь (включая УЗИ и даже цистоскопию с тщательным соблюдением мер асептики и антисептики). Если операция проводится с пересечением уретры или, точнее, если ее не удается сохранить, то через шейку ревизуется полость мочевого пузыря. При этом могут быть удалены камни мочевого пузыря. Ч. А. Синкявичус (1977) рекомендовал производить Y-образное надсечение задней поверхности мочевого пузыря. Дренирование его лучше проводить 3-ходовым катетером Фолея, но можно ограничиться и нелатоновским, фиксируя его к уздечке полового члена. Рана соединительнотканной общей капсулы АПЖ ушивается одно- или двухрядными кетгутовыми швами (рис. 43, г). При отсутствии расширенных предпузырных вен мы накладываем 2 полукисетных кетгутовых шва, которые затягиваем у средней линии. Предварительно держалки-швы над узлами отсекаются. Если накладываются обычные узловые швы, то держалки связываются. К ране общей капсулы АПЖ с обеих сторон позадилобково подводятся дренажи, накладываются послойные швы на операционную рану. Дренирование катетером мочевого пузыря продолжается 5-7 дней, но может быть сокращено вдвое, но тогда на 8-10-й день проводится бужирование.
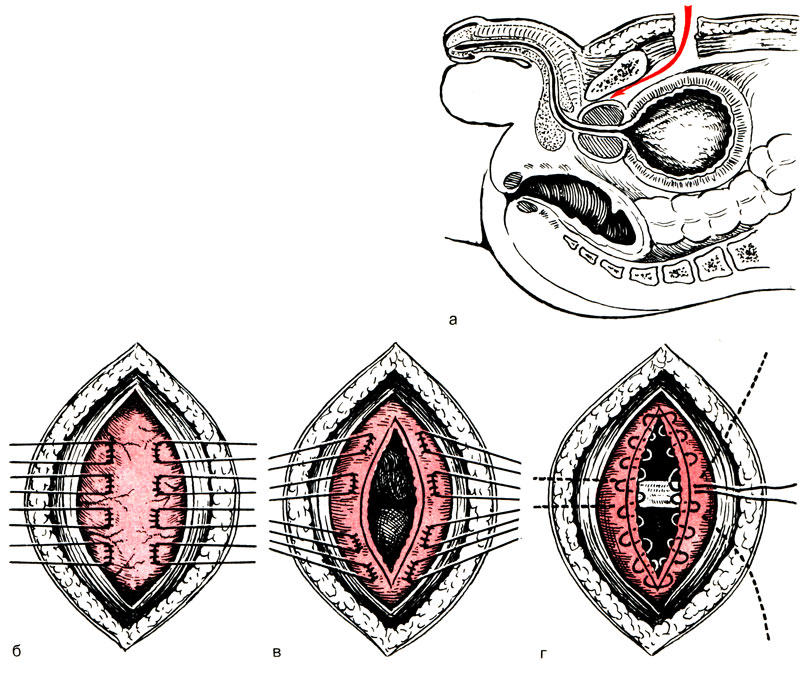
Рис. 43. Позадилобковая аденомэктомия по Лидскому. а - схема подхода непосредственно к АПЖ; б - двухрядное прошивание соединительнотканного вместилища АПЖ дистальнее мочевого пузыря; в - разрез соединительнотканной капсулы над аденомой, дистальнее мочевого пузыря; г-АПЖ удалена; наложены 2 полукисетных шва на рану соединительнотканного вместилища, виден катетер Фолея (или сохранная предстательная часть уретры)
Позадилобковую аденомэктомию мы называем операцией парадоксов. Сложная по оперативной технике операция для "первых хирургов", она отличается сравнительно легким послеоперационным течением, отсутствием кровотечений. В то же время она может привести к такому тяжелейшему осложнению, как остеит лобковых костей. Причем возможность возникновения остеита прямо пропорциональна уровню оперативной техники хирурга и во многом связана с освоением методики.
Техника трансурвтральной резекции АПЖ (ТУР). Перидуральная анестезия является методом выбора. На операционном столе больному придается положение для промежностных операций с изоляцией тела от металлических частей. Пассивный электрод фиксируется к бедру. Наружные половые органы, промежность и анальное отверстие обрабатываются спиртом и йодинолом. ТУР начинается с цистоскопии - ревизии полости мочевого пузыря. При наличии конкрементов, особенно если они прежде не были выявлены рентгенологически, производится литотрипсия. Если она не продолжительна и не травматична, то проводится и собственно ТУР.
В. Я. Симонов (1982) начинает электрорезекцию с удаления средней доли. Это обеспечивает лучший дальнейший обзор, приток ирригирующей жидкости и эвакуацию кусочков аденоматозной ткани. При необходимости прервать операцию это обеспечивает паллиатив, который может привести к восстановлению нормального мочеиспускания. В последующем проводится электрорезекция правой доли, начиная с ее верхнего отдела, затем левой доли. Срезы проводятся до мышечного слоя в глубину и до семенного бугорка книзу, в конце операции-под контролем пальца, введенного ректально (рис. 44). Операция заканчивается электрокоагуляцией кровоточащих сосудов и введением катетера Фолея, лучше трехходового. По ходу операции полость мочевого пузыря отмывается от сгустков крови раствором фурацилина 1 : 3000 при помощи шприца Жане. Вводятся гемостатические препараты (дицинон, андроксоний и др.), переливается кровь.
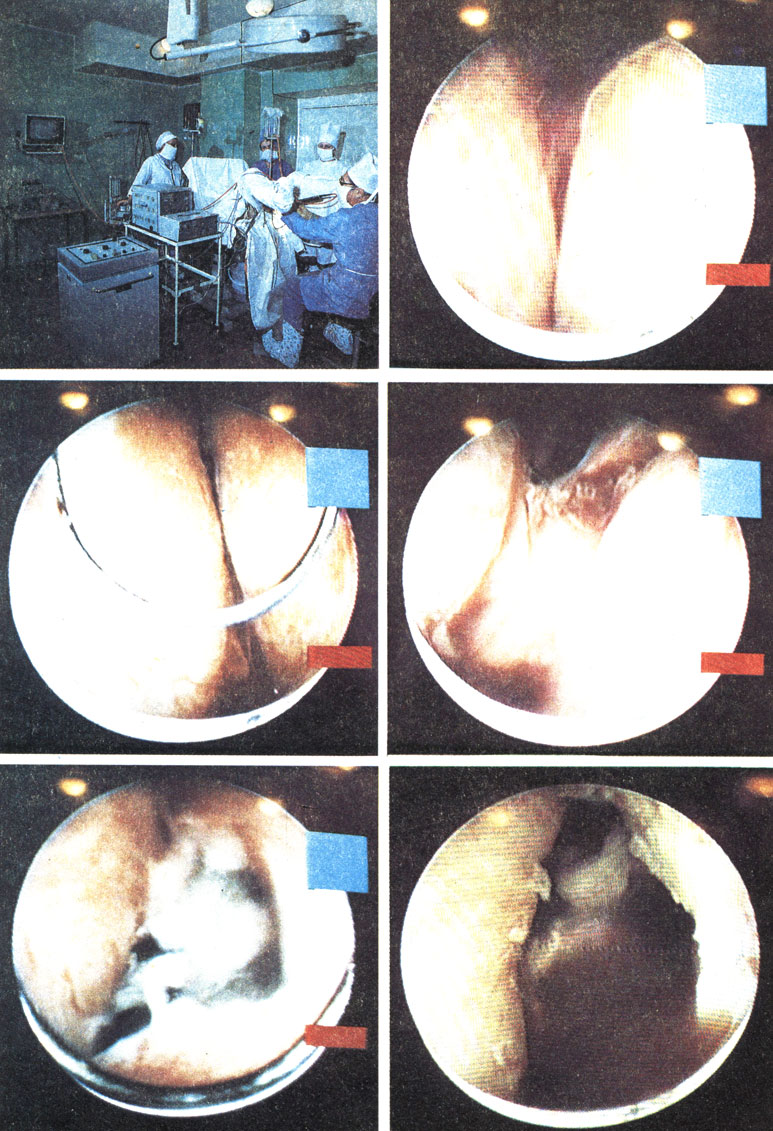
Рис. 44. Трансуретральная электропростатаденомэктомия: а - общий вид операции; б - е - этапы ТУР
Наш сотрудник И. Ф. Новиков (1985, 1988) на материале в 600 ТУР отмечает, что в сущности у большинства больных производится трансуретрально электроаденомэктомия. В то же время при наличии противопоказаний при тяжелых сопутствующих заболеваниях возможны и паллиативные электрорезекции - рассечение АПЖ (Новиков И. Ф. и др., 1988).
Однако ТУР лучше выполнима при АПЖ небольших размеров - до 50 г, в крайнем случае не более 70 г, особенно при аденоме средней доли. При плотной консистенции АПЖ ТУР лучше выполнима, поэтому она показана при сочетании аденомы с простатитом и даже опухолью.
В первые часы после ТУР и в послеоперационном периоде возможны пузырные кровотечения, которые обычно останавливаются консервативными мероприятиями. После ТУР гемотрансфузии, поданным нашей клиники, приводимым А. Н. Берковичем и Э. С. Зеленченком (1988), производятся чаще, чем после аденомэктомии.
Такое осложнение электрорезекции АПЖ, как "ТУР-синдром", обусловленное постоянной ирригацией мочевого пузыря, приводящей к гипонатриемии - менее 120 ммоль/л, наблюдалось нами у 2 больных. Так же редко "ТУР-синдром" имел место у N. Weis и соавт. (1987) - у 6 из 534 больных, перенесших электрорезекцию АПЖ. При этом внутрипузырное давление у них не превышало 10 см вод. ст., а для ирригации использовался 1,5% раствор глицина. Лечение осложнения должно быть направлено на ликвидацию гипонатриемии, гиперволемии и сердечной недостаточности.
Трансуретральная криодеструкция - метод паллиативный, рассчитанный на применение у больных АПЖ с тяжелыми сопутствующими заболеваниями или осложнениями, которым невозможно провести оперативное вмешательство, ТУР. Длительным воздействием на ткань АПЖ можно привести к тотальному некрозу, но тогда в зону его действия может попасть и стенка мочевого пузыря, что приведет к некрозу ее, мочевым затекам и уросепсису. Объясняется это тем, что действие криозонда, на кончике которого температура падает до -186 °С, а в ткани АПЖ достигает -140 °С, мало управляемо по протяженности.
Многолетний опыт проведения этой инструментальной операции [Тиктинский О. Л., 1973; Пархомчук Н. А. и др., 1988], которую очень легко переносят больные при обычном и благоприятном ее выполнении, позволил нам выработать следующую тактику.
Криодеструкция проводится открытым методом, при наличии мочепузырного надлобкового свища. Цель ее заключается не в полном разрушении АПЖ, а в создании "дорожки", тоннеля в ней. Под внутривенным кратковременным наркозом или перидуральной анестезией через уретру в мочевой пузырь вводится криозонд. Кончик его выходит из предстательной части уретры на 2 см. Снижение температуры на криозонде до - 160°С проводится двумя экспозициями по 4 мин с размораживанием после первого сеанса. При больших АПЖ экспозиция достигает 5 мин. Этим достигается значительное поражение тканей, но оно ограничивается по протяжению. Спустя 1-l ½ нед больные выписываются для амбулаторного лечения (антибиотики, спазмолитики, введение в мочевой пузырь и уретру ферментов и др.). Больной выписывается домой с надлобковым свищом. За 6-8 нед некротизированные части АПЖ отторгаются и выделяются через дренаж. Это время больной находится на амбулаторном лечении. Спустя 2 мес он снова поступает в клинику для неоперативного закрытия свища (ведение на катетере).
Наш материал включает 254 больных АПЖ, леченных криодеструкцией. Закрытие мочепузырного свища имело место у 84,8% больных. У некоторых больных криодеструкция произведена повторно, другим была сделана аденомэктомия, что увеличило число леченных с закрывшимися свищами. Следует отметить, что у части больных после криодеструкции улучшалось общее состояние, что связано с иммунологическим фактором. Такой эффект отмечался в литературе. Некоторые больные погибли спустя несколько лет от сердечно-сосудистой и сердечно-легочной недостаточности в связи со своими основными заболеваниями. Криодеструкцию плохо переносят больные с сахарным диабетом. Используются криодеструкторы СЕ-К и КАИ-1.
Результаты оперативного лечения обычно оцениваются по таким показателям, как летальность, койко-день и осложнения, ближайшие и поздние. При этом почти всегда делается попытка связать их со способом оперативного вмешательства. Послеоперационная летальность ниже у больных, оперированных одномоментно с глухим швом и позадилобково по Лидскому - Миллину. Она выше у больных после аденомэктомии одномоментной без глухого шва и при наличии мочепузырного свища. Однако связывать более высокую летальность у больных с мочепузырным свищом только с методикой операции было бы неправильно. Контингент больных, которые не оперируются одномоментно, более тяжелый, с большим числом сопутствующих заболеваний. Мочепузырные свищи в свое время им накладывались по жизненным показаниям, и о двухмоментной аденомэктомии нельзя было и предполагать.
Койко-день в большей степени зависит от способа одномоментной аденомэктомии. После одномоментной аденомэктомии с глухим швом с гидростатическим гемостазом он, по нашим данным, равен 13,4, с выведением нитей на промежность - 15,1, у больных, оперированных позадилонно, - 13,0, без глухого шва - 18,7. Более продолжителен койко-день у больных с мочепузырным свищом - 21,2.
Послеоперационные осложнения, их лечение и профилактика. Наиболее частым и грозным осложнением послеоперационного периода, при котором может потребоваться хирургическое лечение, является кровотечение из ложа предстательной железы. Оно проявляется внезапно, усилившейся слабостью, болью над лобком и в животе. Голова больного становится влажной, покровы тела бледные. На повязке или дренажной трубке появляется алая кровь. При осмотре выявляются частый пульс слабого наполнения, низкое артериальное давление. Пальпируется и перкутируется увеличенный мочевой пузырь, переполненный кровяными сгустками. При исследовании крови выявляются выраженные признаки анемизации.
При неэффективности консервативной гемостатической терапии, включающей и гемотрансфузию, при продолжающейся тампонаде мочевого пузыря производят промывание его полости антисептическими растворами, отмывание ее от сгустков крови. Иногда это проводят неоднократно. Если все эти мероприятия неэффективны, то возникает вопрос о вскрытии полости мочевого пузыря и тампонаде ложа АПЖ марлевым тампоном. Это проводится под общим обезболиванием, под прикрытием гемотрансфузии. Однако это вмешательство приходится проводить довольно редко. По нашим данным, это имело место после аденомэктомии лишь в 1,4% наблюдений, после ТУР - в 1,3%.
Тромбоэмболические осложнения являются наиболее частой причиной смерти больных после аденомэктомии (Шевцов И. П., Горячев И. А., 1986]. Самое грозное из них - это тромбоэмболия легочной артерии, проявляющаяся внезапно наступившими расстройствами дыхания и сердечной деятельности и в считанные минуты приводящая к смерти. Иногда диспноэ, цианоз, падение артериального давления выражены умеренно, и больной в тяжелом состоянии остается жить, а при проведении интенсивного антикоагулянтного, ферментного и гормонального лечения может выздороветь.
Профилактика этих осложнений включает раннее вставание больных, а также назначение ацетилсалициловой кислоты по 0,5 г 2-3 раза в день, бутадиона по 0,1 г X 3 раза в день в течение 1-2 нед начиная с 2-3-го дня после операции. У больных, входящих в группу риска (хронический тромбофлебит, варикозное расширение вен нижних конечностей, перенесенный в ближайшие 1-2 года инфаркт миокарда и др.), имеются показания к лечению антикоагулянтами, в частности гепарином по 5000 ME 2 раза в сутки внутримышечно. С 1973 г. в нашей клинике применяется тактика активной профилактики тромбоэмболии легочной артерии, заключающаяся, помимо бинтования ног эластическим бинтом, в оперативной перевязке большой подкожной вены бедра непосредственно перед аденомэктомией [Михайличенко В. В., Тиктинский О. Л., 1988]. Операция обоснована флебографическими исследованиями, выполненными ранее на кафедре [Райнигер О. С., 1973]. Они выявили наличие расширенных анастомозов между системой большой подкожной вены бедра и венами таза при варикозной болезни.
Проведение аденомэктомии без наложения швов на ложе АПЖ, с постоянным гидростатическим гемостазом, приводящим к вымыванию фибринолитических веществ, по данным урологических клиник кафедры, сократило число тромбоэмболий легочных артерий в 2,3 раза.
Острый пиелонефрит после аденомэктомии чаще наблюдается у больных с сопутствующими камнями в почках и мочеточниках или после травматичной аденомэктомии [Пытель Ю. А., Золотарев И. И., 1986]. Это осложнение имело место в 3,1% наблюдений. Однако в их число не включены кратковременные подъемы температуры тела, которые можно объяснить уретральной лихорадкой или однократным пузырно-мочеточниково-лоханочным рефлюксом. Заболевание проявляется подъемом температуры тела, умеренной болью в поясничной области, познабливанием, слабостью, адинамией. Покровы лица гиперемированы, пальпация области почки и сотрясение поясничной области болезненны. С появлением потрясающего озноба с падением артериального давления и уменьшением диуреза надо думать о бактериемическом шоке.
Лечение острого пиелонефрита должно быть этиотропным, с учетом выделенной из мочи бактериальной флоры и чувствительности ее к антибиотикам. Необходимо чаще применять антибактермальные препараты широкого спектра действия. Вновь ставится вопрос о дооперационной антибактериальной терапии. Возросла роль иммунологического лечения не только при хроническом пиелонефрите, но и в активной фазе его. При остром пиелонефрите, возникшем после операции, возможен переход серозного воспаления в гнойное, при этом возникают показания к неотложной люмботомии, нефро- или пиелостомии и декапсуляции почки.
При расстройствах акта мочеиспускания, при выраженном цистите в отдаленные сроки после операции всегда надо предполагать хирургическую причину дизурии, поллакиурии и странгурии. Незначительные субклинические расстройства мочеиспускания можно выявить при урофлоуметрии, цистометрии. Окончательный диагноз осложнения можно поставить при проведении уретрографии, микционной цистоуретрографии.
Основные хирургические осложнения аденомэктомии: стриктуры шейки мочевого пузыря с образованием "предпузыря" или стриктуры задней части уретры - имели место на нашем материале соответственно у 3,9% и 1,5% больных, перенесших трансвезикальную аденомэктомию. Реконструктивные операции произведены у 57 больных с Рубцовыми стенозами и облитерацией шейки мочевого пузыря и у 11 - со стриктурами уретры. За последние годы мы завершаем резекцию шейки мочевого пузыря не введением циркулярного дренажа, а проведением через уретру в мочевой пузырь 2 полиэтиленовых трубок одинакового диаметра и наложением глухого шва с последующим непрерывным орошением растворами фурацилина 1 :3000 с добавлением метилурацила. Более чем у 90% оперированных были получены положительные результаты. При стриктурах задней части уретры промежностная пластика уретры с резекцией стриктуры произведена только у 3 больных, в прошлом перенесших уретрит. В остальных наблюдениях проводились чреспузырные оперативные вмешательства по способу В. П. Тараканова (1985). У 2 больных возникла необходимость в повторных оперативных вмешательствах. Часть больных после операции бужируется. Лечение больных с камнями мочевого пузыря, возникшими после аденомэктомии (23 наблюдения), проводилось в основном путем электрогидравлической литотрипсии.
Особое место занимают больные с камнями "предпузыря" и мочевого пузыря. В основном это те, у которых операция протекала осложненно и в последующем развился щелочной цистит. Почти у всех больных в анамнезе были указания на камневыделение, почечные колики, поэтому в послеоперационном периоде и в последующем их надо вести, как страдающих мочекаменной болезнью.
Все осложнения аденомэктомии сопровождаются мочевой инфекцией, циститом и пиелонефритом, поэтому пациенты нуждаются в длительной антибактериальной терапии, которая должна быть этиотропной.
Анализ данных из литературы и собственные наблюдения свидетельствуют о профилактической роли вазорезекции или вазотомии в возникновении послеоперационных эпидидимитов. Вазолигатура при этом малоэффективна. Эпидидимиты у оперированных таким образом возникли в 2,2% наблюдений. У больных моложе 60 лет вопрос о вазорезекции решается индивидуально, в зависимости от общего состояния больного, наличия пиелонефрита и цистита, половой активности.
Нарушение копулятивной и репродуктивной функций. После аденомэктомии эти нарушения наступают у больных с сочетанием АПЖ с простатитом, когда при удалении аденомы парауретральных желез вследствие сращений выделяется собственно предстательная железа. Эндокринные влияния простатэктомии могут способствовать возникновению эректильной импотенции. Вазорезекция изменяет эффект эякуляции. Некоторых больных это волнует, поэтому в отдельных наблюдениях могут возникнуть показания к пластическому восстановлению проходимости семявыносящих протоков. Однако и у больных, которым не проводилась вазорезекции, возможны нарушения эякуляции. При чреспузырной аденомэктомии возможно удаление или разрушение семенного бугорка, тогда эякулят поступает в мочевой пузырь и выделяется с мочой. Вопрос о восстановлении репродуктивной функции у больных после аденомэктомии в связи с возрастом, как правило, не возникает. При признаках эректильной импотенции назначаются небольшие дозы половых гормонов и ЛОТ, возможно применение эректоров. В крайних социальных ситуациях возникают показания к интракавернозному шинированию.
Рак предстательной железы
Эпидемиология. Частота рака предстательной железы неоднородна в разных странах. В США рак этой локализации занимает 2-е место среди злокачественных заболеваний у мужчин, составляет 18% от вновь выявленных опухолей и 10% всех смертей среди этих больных [Flanders W., 1984]. Выявлена этиологическая связь с рационом больных, что особенно заметно в этнографических группах. В Японии, где эта болезнь встречается значительно реже, отмечена наибольшая заболеваемость среди принимающих европейскую пищу [Mishina Т. et al., 1985]. В Испании отмечается увеличение заболеваемости с 7,05% в 1951 г. до 9,88% в 1965 г. и до 12,66% в 1979 г. [Sabater Pons A. et al., 1986]. Одновременно наблюдается и увеличение смертности, в основном в старших возрастных группах. На севере Канады заболеваемость РПЖ составляет 23, на юге - 46,2, в Скандинавии - 44, в Польше 6,2 на 100000 населения [Ayiomamilis А., 1987].
В нашей стране заболеваемость РПЖ составляла 1-2% [Шабад Л. М., 1949], а в последние десятилетия достигла 4% [Маринбах Е. Б., 1975]. Значительно чаще РПЖ встречается в западных странах. W. Jordan и J. Greager (1967) отмечают, что заболеваемость РПЖ в США среди белых составляет 34,8 заболевания на 100000 населения, среди цветных - 49,9. Эта локализация рака среди китайцев и японцев встречается исключительно редко. В то же время в некоторых странах в Европе РПЖ занимает 3-е место среди всех онкологических заболеваний [Hartung R., Makermayer W., 1979]. Возраст больных РПЖ обычно превышает 50 лет. У более молодых лиц это заболевание встречается сравнительно редко.
Этиология и патогенез. Издавна была установлена зависимость нарушений функции эндокринных желез и возникновения РПЖ. Е. В. Пеликаном (1875) в наблюдениях над скопцами, А. Г. Подрезом (1896) - над меринами установлена выраженная атрофия предстательной железы. Вскоре были сделаны попытки оперативной эндокринной коррекции при заболеваниях предстательной железы. В 1884 г. Ф. И. Синицын произвел двустороннюю орхиэктомию двум больным АПЖ. Хотя его действия и были ошибочными, так как после удаления яичек гормональный баланс смещается в сторону преобладания эстрогенов над андрогенами, что ведет к росту АПЖ, это была попытка оперативной коррекции обмена половых гормонов. В последующем Ramm (1893) и Withe (1893), а в нашей стране - И. К. Спижарный (1894) и Ф. И. Березкин (1896) произвели кастрацию у больных РПЖ. Полученный клинический эффект, обусловленный смещением эстрогенндрогенного баланса в сторону снижения содержания андрогенов, послужил подтверждением их роли в генезе РПЖ.
Исследованиями установлена явная генетическая зависимость, так как встречается семейная заболеваемость РПЖ [Meike A. et al., 1984]. P. Huber (1984) указывает на наличие генетических маркеров, среди которых он выделяет кислую фосфатазу.
Патогенез РПЖ обусловлен повышением активности гипоталамо-гипофизарной функции, которая приводит к изменению гипоталамо-гипофизарной системы, что ведет к изменениям гормонообразования в надпочечниках и половых железах. Эти изменения проявляются повышением в сыворотке крови уровня половых гормонов, 2/3 которых выделяются корой надпочечников, а 1/3 - гландулоцитами яичек.
Возникновение РПЖ связывают с наличием гормонально-зависимых зон в этом органе, находящихся под контролем мужских или женских половых гормонов. По мнению S. Gil-Vernet (1962), краниальная, или центральная, ее часть, охватывающая зону расположения предстательной части мочеиспускательного канала, находится под влиянием эстрогенов. У значительного числа мужчин в пожилом возрасте гормональный баланс нарушается в сторону преобладания женских половых гормонов, которые, воздействуя на краниальную часть предстательной железы, приводят к образованию аденомы в одной или нескольких парауретральных железах. Этим обусловлены и расстройства мочеиспускания, которые при аденоме наступают у большинства больных довольно рано. Каудальная часть предстательной железы находится под контролем мужских половых гормонов. Если уровень андрогенов в крови повышается и гормональное равновесие смещается в их сторону, то в этих отделах железы может возникнуть атипия эпителиальных клеток ацинусов и со временем образоваться узел рака. Поэтому неслучайно рак развивается больше в боковых отделах железы на периферии, близко к капсуле, что особенно заметно в начальной стадии заболевания, когда узел опухоли одиночный. Этим и объясняется позднее появление расстройств мочеиспускания. Острая задержка мочи, как правило, наступает в III-IV стадиях, реже во II. Это находит подтверждение в исследованиях М. Ogawa (1967). Им проведен анализ оволосения, половой активности и особенностей питания у 434 больных АПЖ и у 47 РПЖ. При АПЖ он наблюдал меньшую волосистость на лобке, на груди, пониженную половую активность. При РПЖ вторичные половые признаки были иными: волосы на лобке росли обильно по остроконечному типу; половая активность пациентов была повышена.
По мнению JI. М. Шабада (1954), генез РПЖ обусловлен появлением в крови канцерогенных веществ, возникающих вследствие нарушения обмена половых гормонов. Клинические и экспериментальные исследования А. М. Гаспаряна и А. С. Портного (1970) дали им основания считать, что патогенез РПЖ обусловлен повышением активности гипоталамо-гипофизарной системы, что приводит к изменениям гормонообразования в надпочечниках и половых железах.
Определенную роль в патогенезе РПЖ, как показали исследования S. Szendroi и др. (1963), играет печень - орган, в котором происходит распад избытка образующихся в организме андрогенов. При поражении ее этот процесс нарушается, что приводит к гиперандрогенизации. В связи с этим у больных РПЖ иногда наблюдаются нарушения свертывающих и антисвертывающих систем крови, выявляются плеторные симптомы, эритремия, так называемый симптом Майрано - Риготти [Mairano С., Rigotti Е., 1960]. Среди больных циррозом печени РПЖ встречается чаще, чем у других лиц.
Гормональный генез РПЖ не исключает и влияния химических веществ. В эксперименте это было доказано Б. В. Ключаревым (1954), получившим РПЖ у крыс при введении в нее канцерогенных веществ. Возможно, этим можно объяснить большую заболеваемость раком этой локализации в городах, в высокоразвитых промышленных странах. Не исключается влияние урбанизации на рост заболеваемости. Роль генетически-расовых факторов требует изучения, проведения дальнейших исследований.
Патологическая анатомия. Макроскопически предстательная железа представляется деформированной, бугристой или узловатой. Отдельные узлы опухоли располагаются близко к капсуле железы, больше кзади и латерально, чаще асимметрично. На размере опухоль беловато-серого цвета, иногда с участками некроза. Консистенция плотная.
Гистологически РПЖ делится на 2 группы: высоко- и малодифференцированные опухоли. В. Л. Бялик (1971) различает и промежуточные формы, подразделяя РПЖ по гистологическому составу на 3 вида: 1) дифференцированные формы (аденокарциномы, светло- и темно-клеточные тубуло-альвеолярные раки, криброзный, переходноклеточный и плоскоклеточный); 2) малодифференцированные формы (анапластическая аденокарцинома, солидный и скиррозный раки); 3) недифференцированные мелко- и полиморфноклеточный раки.
При гормональном лечении гистологическая картина предстательной железы характеризуется атрофией эпителиальных элементов вплоть до некробиоза раковых клеток. Железистые опухоли могут превратиться в эпителиальные тяжи атрофированных клеток. Некоторые раковые клетки сохраняются длительно, чем и объясняются рецидивы заболевания, если гормональное лечение прекращается или возникает приобретенная вторичная гормональная резистентность.
Метастазирование опухоли происходит по лимфатическим сосудам в регионарные подвздошные и паховые лимфоузлы, гематогенным артериальным путем - в легкие, печень, позвоночник, по венам - в подвздошные кости. Гистологически метастазы обычно напоминают дифференцированный узел РПЖ. Отмечаются некоторые закономерности: метастазы в лимфатические узлы не сочетаются с метастазированием в кости.
При РПЖ опухолевые клетки попадают в кости таза по венозной системе.
Классификация. Международным противораковым союзом в 1968 г. для испытания на несколько лет была принята классификация по системе TNM: Т - первичная опухоль, N - метастазы в регионарные лимфоузлы и М - отдаленные метастазы. Ею пользуются до настоящего времени во многих странах мира, в том числе и в СССР. В основу ее положены объективные признаки локализации, размеров опухоли, прорастания капсулы предстательной железы и окружающих органов, что в основном можно установить пальпаторно. Это и является ее недостатком.
Классификация по системе TNM
Т0 - опухоль не определяется; Т1 - опухоль занимает менее половины предстательной железы и окружена неизмененной тканью; Т2 - поражена половина предстательной железы, но это не вызывает ее деформации и увеличения; Т3 - опухоль вызвала увеличение предстательной железы и ее деформацию, но не вышла за пределы капсулы; Т4 - отмечается прорастание капсулы, окружающих тканей и органов; Тх - нельзя исключить рак предстательной железы; N0 - метастазы в регионарные подвздошные и паховые лимфоузлы не обнаружены; N1 - имеются отдельные метастазы в подвздошных и (или) паховых лимфоузлах; Nx - установить по данным обследования наличие или отсутствие метастазов в регионарные лимфоузлы невозможно; М0 - отдаленных метастазов нет; Ml - отдаленные метастазы в костях; М2 - метастазы в костях и других органах; Мх - нельзя исключить наличие метастазов.
Симптоматика и клиническое течение. У многих больных РПЖ отмечается длительный бессимптомный период. Симптомы заболевания можно разделить на 2 группы: обусловленные собственно РПЖ и метастазами и прорастанием опухоли. К первым симптомам относятся боль, расстройства мочеиспускания, гематурия. Боль в промежности при раке I-II стадии может быть незначительной, ноющего характера, что обусловлено давлением на капсулу, в которой заложены нервные окончания. При прорастании ее боли становятся интенсивнее, постояннее. В IV стадии, когда опухоль проросла в окружающие ткани и органы, возникают сильные боли, которые могут быть сняты только введением наркотических веществ. При этом боли иррадиируют в крестец, прямую кишку. Расстройства мочеиспускания появляются поздно, при асимметрии и деформации железы, т. е. в III стадии, когда может наступить и сдавление предстательной части мочеиспускательного канала. Объясняется это тем, что узел опухоли начинает расти в каудальной, или периферической, части железы, которая находится под влиянием андрогенов. У некоторых больных, как и при АПЖ, появляются поллакиурия, никтурия, странгурия. Однако чаще первым проявлением расстройства мочеиспускания бывает острая задержка мочи. В целом "пузырные симптомы" имеют место лишь у 20-25% больных. Гематурия, тотальная макроскопическая, может быть признаком прорастания опухоли в мочевой пузырь, но может быть и проявлением нарушения протромбинообразовательной функции печени. Однако гематурия все же встречается в поздних стадиях заболевания, когда опухоль прорастает в мочевой пузырь.
Первым проявлением РПЖ могут быть симптомы пиелонефрита и даже почечной недостаточности, что наступает вследствие прорастания устьев мочеточников. Признаки пиелонефрита при этом обычные - боли в поясничной области, высокая температура тела, пальпируемая почка (при уретерогидронефрозе), лейкоцитурия. При хронической почечной недостаточности больные жалуются на слабость, сухость во рту, жажду.
Боли в костях могут быть первым и единственным клиническим проявлением РПЖ. Локализация боли может быть различной - в крыле подвздошной кости, в крестце, позвоночнике (чаще в поясничном отделе). Боли становятся постепенно постоянными и интенсивными. Возможны патологические переломы при метастазировании в шейку бедра. При метастазах в позвоночник может наступить острая задержка мочи спинального характера. Если опухоль прорастает окружающие ткани, то наступает лимфостаз. Нижняя конечность становится отечной, и отек ее почти не проходит при возвышенном положении конечности. Прорастание в прямую кишку может вызвать кровотечение (появление свежей крови в кале и после дефекации), но это бывает редко. Метастазы в легкие клинически проявляются мало, так как больной прежде погибает от кахексии, хронической почечной недостаточности. Поражения костей таза и позвоночника составляют свыше 80% от всех метастазов при РПЖ.
Ректальная пальпация предстательной железы является основным приемом в объективном обследовании больного. Ведущие пальпаторные признаки рака - это наличие плотных узлов опухоли на периферии рядом с капсулой, асимметрия предстательной железы, увеличенной в поперечном направлении, или равномерно увеличенная железа. Консистенция ее или отдельных узлов плотная, почти хрящевая. Может определяться прорастание опухоли в капсулу или в окружающие ткани в виде тяжей или инфильтратов, но стенка прямой кишки под ней обычно подвижная. Некоторые авторы отмечают малую достоверность ректальной пальпации в диагностике РПЖ.
Общее состояние больного длительное время не изменяется или зависит от сопутствующих возрастных заболеваний, что выявляется при объективном исследовании, особенно органов грудной полости. В органах грудной клетки выявляются возрастные изменения. При распространенных метастазах в легкие могут быть укорочение перкуторного звука, уменьшение экскурсии легкого на стороне поражения, ослабленное везикулярное дыхание. При прорастании устья мочеточника пальпируется увеличенная, болезненная почка. При метастазах в кости определяют местную болезненность, ограничение подвижности конечности. Неврологические симптомы наблюдаются при метастазах в позвоночник, спинной мозг.
Диагностика. Симптомы заболевания настораживают в отношении РПЖ. Результаты пальцевой ректальной пальпации длительное время были чуть ли не единственным диагностическим критерием этого заболевания. В последние годы диапазон диагностических возможностей значительно расширился, что объясняет появление новых технических методов и средств.
Диагностика начинается с лабораторных исследований. Изменения крови по клиническим анализам могут длительное время отсутствовать. У некоторых больных РПЖ I, II и даже III стадии СОЭ остается нормальной. Лейкоцитоз и сдвиг в лейкоцитарной формуле определяются в активной фазе хронического пиелонефрита или при инфицировании уретерогидронефроза, они могут быть обусловлены прорастанием опухолью стенки мочевого пузыря и устья мочеточника при IV стадии заболевания. Участие в патогенезе этого заболевания печени у некоторых больных приводит к нарушению свертывающей и антисвертывающей системы крови. Иногда изменения крови проявляются эритремией, достигающей 6·1012/л и выше.
При осложнениях двусторонним пиелонефритом, уретерогидронефрозом заболевание проявляется хронической почечной недостаточностью. В сыворотке крови таких больных выявляются повышение содержания мочевины и креатинина, изменения средних молекул. Придается значение исследованию активности ферментов в плазме крови (кислой и щелочной фосфатаз, лактатдегидрогеназы, креатининкиназы), а также гидроксипролина мочи, уровень которых повышается [Brendlier Н., 1980; Wirth М., Osternage Н., 1981]. В то же время увеличение активности в крови кислой и щелочной фосфатазы является неспецифической реакцией и зависит от возраста и поражениях тех органов и тканей, в которых они образуются. К. Liewendahl и др. (1984) при выявленных сцинтиграфией метастазах в костях установлено повышение уровня в крови кислой простатической фосфатазы на 84%, активной - на 85%.
Иммунологическая диагностика имеет не столько диагностическое, сколько прогностическое значение. Среди иммунологических методов имеет значение определение электрофоретической подвижности γ-глобулина. Антиген синтезируется эпителием опухолевой ткани. При этом заболевании уровень γ-глобулина предстательной железы снижается [Николаев А. А. и др., 1980]. Лимфоциты трансформируются.
Установлено влияние РПЖ на тест миграции лейкоцитов и на реактивность лимфоцитов, стимулированную фитогемагглютинином. По рецепторной активности лимфоцитов Т в тестах розеткообразования дифференцируются РПЖ и АПЖ [Turewski G. et al., 1984]. Изменения, обнаруживаемые при общем анализе мочи, не носят специфического характера, они зависят от вторичных воспалительных изменений в почках и мочевом пузыре (лейкоцитурия, эритроцитурия, протеинурия). Имеют значение цитологические исследования секрета предстательной железы, 3-й порции мочи, получаемые после массажа предстательной железы, что, однако, нежелательно, так как эта процедура может привести к метастазированию опухоли. Менее опасной в этом отношении следует считать аспирационную биопсию [Fujioka F. et al., 1984; Chodak G. et al., 1986]. Рекомендуется проводить трансректальную биопсию тонкой длинной иглой, вводя ее на 10 см под контролем пальца, пользуясь сухим шприцем; эффективность диагностического метода отмечается у 2/3 больных. Е. Б. Маринбах (1975) проводит аспирационную пункцию следующим образом. При коленно-локтевом положении или на кресле в уретру вводят тубус уретроскопа и через него - тонкую иглу, острие которой погружается в подозрительный на опухоль участок предстательной железы. Цитологическое исследование проводится под люминесцентным микроскопом. Признаками атипии клеток при РПЖ являются: 1) увеличение и полиморфизм; 2) крупное ядро, несколько ядер; 3) дегенеративные изменения в виде жирового, вакуольного и зернистого перерождения в протоплазме.
Рентгенологические исследования. С помощью обзорной рентгенографии таза и поясничного отдела позвоночника можно выявить метастазы, которые чаще поражают крестец, крылья подвздошных костей, нижние поясничные позвонки и реже - эпифизы трубчатых костей. Они имеют округлую форму или носят распространенный остеобластический характер, имеют вид гемогенной бесструктурной массы, имеющей пятнистость и волокнистость. Они бывают настолько характерны, что опытный рентгенолог может первым поставить диагноз РПЖ. Деформирующая остеодистрофия (болезнь Педжета), от которой нужно дифференцировать эти метастазы, отличается по локализации изменений. При этом поражаются не только кости таза и трубчатые, даже большеберцовая, кости, но также и череп. Кости искривлены, утолщены, имеются явления остеопороза, перекрещивание костных пластинок, сужение костномозгового канала. Метастазы в позвонках имеют такой же остеобластический вид, с поражением дужек и островков, с компрессионными изменениями, но с сохраненными межпозвонковыми хрящевыми дисками.
Экскреторной внутривенной урографией можно выявить снижение функции почек, расширения полостей мочеточника и почки, что может иметь место при прорастании опухоли в устье мочеточника и пиелонефрите. На нисходящей цистограмме и пневмоцистограмме (простатограмме) виден дефект наполнения мочевого пузыря за счет увеличенной предстательной железы. Для РПЖ характерны умеренное ее увеличение, асимметрия, неровные контуры, что отличает его от АПЖ, где дефект больших размеров в виде конуса вдается в мочевой пузырь, имеет ровные края.
Компьютерная томография предстательной железы позволяет выявить различную плотность опухолевой и непораженной ткани, установить объем и степень поражения органа (рис. 45). В то же время некоторые авторы не придают большого значения компьютерной томографии. По данным S. Mukamel и др. (1986, 1987), томография далеко не всегда помогает установить прорастание рака в капсулу предстательной железы и в семенные пузырьки и даже дифференцировать его от АПЖ. Среди рентгенологических методов не утратила значения везикулография. Она производится для установления по косвенным признакам размеров предстательной железы и прорастания опухоли за пределы пораженного органа в окружающие ткани, что имеет значение для установления стадии рака и решения вопроса о выборе метода лечения.
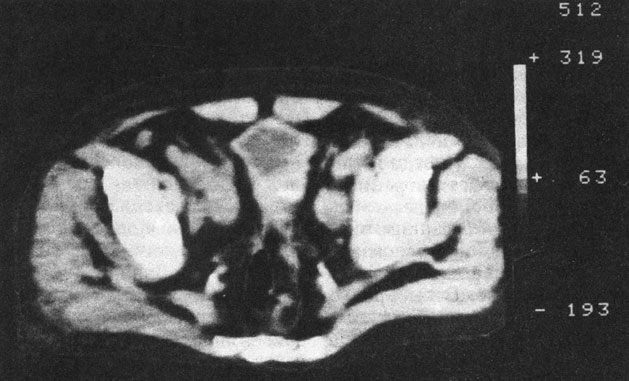
Рис. 45. Компьютерная рентгенограмма при РПЖ с прорастанием в окружающие ткани
Техника везикулографии, предложенная еще в 1913 г. W. Belfield, почти не изменилась. Все попытки пункционного введения контрастирующего вещества в семявыносящий проток оказались нецелесообразными. Везикулография является небольшой диагностической операцией. Семявыносящий проток обнажается маленьким разрезом на мошонке (как для вазорезекции при аденомэктомии). Производится небольшая поперечная поверхностная надсечка на протоке, после чего в его просвет проксимально вводится игла, конец которой тупо сточен, и фиксируется кетгутом. Вводится 5-6 мл любого ампулированного контрастирующего вещества, применяемого в урологии, после чего сразу же производится рентгенограмма. Лучше пользоваться 4-5 мл 30% раствора йодолипола, разведенного в 1 мл эфира. При этом рентгенографию можно проводить спустя 1 ч и более, а затем и на другой день.
Различают следующие везикулографические признаки РПЖ: 1) смещение семявыносящего протока латерально; 2) деформация его; 3) сужение просвета протока за счет сдавления опухолью; 4) деформация семенного пузырька или пузырьков; 5) деформация предстательной части мочеиспускательного канала, что можно выявить, если контрастирующее вещество попадет в его просвет; 6) расширение полостей семенного пузырька на месте сужения в области его собственного протока и семявыбрасывающего. При везикуло- или генитографии можно выявить следующие рентгенологические симптомы, указывающие на прорастание опухоли: 1) ампутацию семенных пузырьков; 2) затекание контрастирующего вещества за их контуры; 3) неполное заполнение просвета семенных пузырьков в сочетании со скоплением йодолипола вне полости.
Тазовая лимфаденография, предложенная и описанная J. Kinmonth в 1952 г., предназначена для выявления метастазов в регионарные лимфоузлы, подвздошные и паховые. Рентгенологическими абсолютными признаками метастазирования по лимфограммам являются: 1) "изъеденность" увеличенных лимфоузлов; 2) наличие коллатеральных лимфатических сосудов. Увеличение лимфатических узлов является относительным признаком наличия опухоли, так как причиной этого может быть воспалительный процесс. Тем не менее гигантские лимфоузлы, даже при отсутствии других признаков опухоли, свидетельствуют в пользу последней.
A. Naragana и соавт. (1985), которые произвели лимфаденомэктомию у 187 больных РПЖ, установили высокую информативность лимфографии. Показана целесообразность сочетания этого вида диагностики с аспирационным цитологическим исследованием [Luciani L. et al., 1985].
В диагностике РПЖ радионуклидные методы не получили широкого распространения и могут иметь значение в основном для дифференцирования от АПЖ. Повышенное содержание фосфора в эпителиальных клетках ацинусов предстательной железы (до 5 г), в большей степени в опухолевых клетках, дает основание применять для исследования нуклид 32Р, что было предложено в 1956 г. G. Zoedler и соавт. Исследование проводится методом контактной радиометрии с радиоактивным двузамещенным натрия фосфатом. Накопление его в предстательной железе определяется через 24, 48 и 72 ч. При РПЖ оно выше, чем у здоровых лиц и у больных АПЖ, не менее чем на 15-20%. В АПЖ содержится относительно большее количество цинка (в норме 0,9 мг на 1 г сухого вещества). Его больше, чем при РПЖ, на этом и основана радионуклидная дифференциальная диагностика. Сцинтиграфия проводится с нуклидами 6oZn и Zn. В большей степени радионуклидные исследования применяются для выявления метастазов в кости. При этом проводят в основном исследования с 85Sr. Препарат вводят внутривенно в дозе 2,6-3,7 МБк (70-100 мкКи). Сцинтиграфия или сканирование проводится через 5-7 сут. Очаговое накопление препарата наблюдается в местах метастазирования вследствие накопления при костных метастазах кальция, метаболизм которого аналогичен таковому стронция. В. Lentie и соавт. (1974) применили полифосфат технеция - 99mТс. Радионуклидное выявление метастазов при РПЖ позволяет на 3-6 мес ранее, чем рентгенологическим методом, диагностировать метастазы в костях.
В последнее время в распознавании РПЖ широкое распространение получило ультразвуковое сканирование, или эхография, основанное на использовании отражения, рассеяния и поглощения ультразвуковых волн от различных по плотности тканей. При этом выявляются размеры предстательной железы, ее конфигурация и контуры, различное соотношение железистой и соединительной ткани, что особенно заметно при динамической эхографии во время гормональной терапии, когда это соотношение изменяется. На эхограммах предстательная железа видна как симметричное полулунное образование длиной 19-22 мм, шириной 40-52 мм, с ровной капсулой, с четким изображением тканей.
При РПЖ характерны асимметрия и увеличение ее в ширину (в латеральном направлении). Она может быть деформирована. Опухоль характеризуется периферическим, или каудальным, расположением. Часто поражается капсула. Выявляется и прорастание, даже с распространением в окружающие ткани. Ультразвуковое сканирование выявляет и распространение ее на семенные пузырьки. Злокачественные образования исключительно гипоэхогенны, что отличает их от здоровых тканей.
Наилучшие диагностические результаты достигаются трансректальной сонографией (рис. 46) с использованием ректального датчика [Lee F. et al., 1986; Dahnert W. et al., 1986, и др.]. Это исследование позволяет выявить перед операцией локализацию опухоли и использовать его для динамического наблюдения в антиандрогенной терапии и даже после орхиэктомии. Тем не менее М. Rifkin и соавт. (1986) считают, что даже трансректальная эндосонография не должна быть единственным методом диагностики РПЖ.
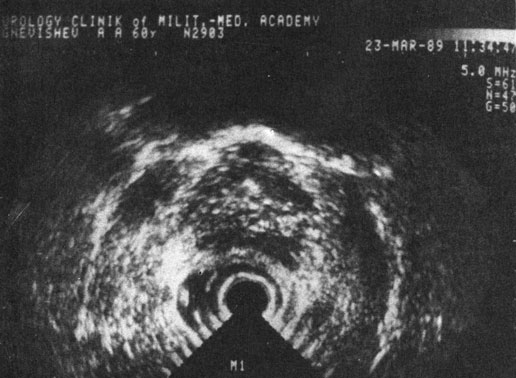
Рис. 46. Трансректальная горизонтальная у льтрасонотомография при РПЖ
Пункционная биопсия дает возможность поставить морфологический диагноз опухоли, установить степень ее дифференцированности и, следовательно, злокачественности и гормональной резистентности. Существует 2 способа пункционной биопсии предстательной железы, которые имеют почти равное число сторонников и достаточно описаны в литературе, - промежностный и трансректальный. Изредка биопсия производится петлей цисторезектоскопа, чаще во время ТУР как срочное исследование. Применяются биопсийные иглы Астральди, Фланкмана, Сильвермана, Трука, Туркеля и мн. др. Отрицательный результат биопсии не исключает наличия опухоли, так как при одиночных узлах в биоптат может попасть неизмененная ткань железы. Пункционную биопсию приходится производить и повторно. Из осложнений следует отметить повреждения сосудов таза и прямой кишки, сопровождающиеся кровотечениями и образованием гематомы, и имплантацию опухоли. Некоторые авторы придают осложнениям при биопсии предстательной железы большое значение [Musierowicz A. et al., 1984]. Однако диагностическая эффективность этого метода достаточно высока [Perzin Р. et al., 1986; Bonney W. et al., 1987, и др.].
Производят пункционную биопсию костей для выявления метастазов в них. Проводится также пункция подвздошного гребня и грудины. При этом удается выявить раковые клетки более чем у 80% больных.
Дифференциальная диагностика проводится прежде всего эхографически с АПЖ, симметричного полулунного образования длиной 19-32 мм, шириной 40-52 мм, с ровной капсулой. При РПЖ отмечаются асимметрия и увеличение ее в ширину (в латеральном направлении), патологические изменения семенных пузырьков при этом не определяются. Предстательная железа может быть деформирована, и ее структурный рисунок иногда не прослеживается, что имеет место при ее большой акустической плотности, когда ультразвуковые волны поглощаются. При инфильтрирующем раке границы железы не определяются.
При АПЖ, от которой в основном приходится дифференцировать РПЖ, предстательная железа на эхограмме увеличена значительно и в основном в переднезаднем направлении. Структура аденомы гомогенная, с участками затемнений правильной формы; при фиброаденоме видны яркие эхосигналы от соединительной ткани.
Пункционная биопсия предстательной железы совместно с трансуретральной сонографией позволяет хорошо дифференцировать РПЖ от АПЖ - железа значительно увеличена на эхограмме, в основном в переднезаднем направлении. Структура аденомы гомогенная, с участками затемнения правильной формы. При фиброаденоме видны яркие эхосигналы от соединительной ткани. Можно выявить и рак в АПЖ. Тогда надо пользоваться сочетанием с лабораторными методами, выявляющими увеличение уровня простатической кислой фосфатазы [Lewenhaupt A. et al., 1985] и нарастания числа В-лимфоцитов [Савинов В. А., Таубкин И. С., 1986].
Лечение. Различают гормональные, оперативные и лучевые методы лечения РПЖ. В последнее время постепенно начинают применять химиотерапию, в основном в сочетании с хирургическими и гормональными методами.
Гормональная терапия РПЖ применяется давно и широко [Ключарев Б. В., 1954]. Несмотря на большие успехи, достигнутые в распознавании этого заболевания, связанные с использованием современных рентгенологических, радионуклидных и ультразвуковых методов, гистологической и цитологической биопсии, 60-70% рака диагностируется в III стадии. Объясняется это каудальной локализацией рака в железе, в ее периферической части, в стороне от предстательной части мочеиспускательного канала. Расстройства мочеиспускания в связи с этим наступают поздно, когда опухоль занимает большую часть предстательной железы, деформирует ее, т. е. в III стадии. Боль в железе выражена, когда опухоль прорастает капсулу и окружающие ткани. Наиболее реальное выявление ранней формы РПЖ возможно в основном при профилактических осмотрах мужчин старше 45-50 лет. По мнению Е. Б. Маринбаха, на 1000 пожилых мужчин можно выявить от 1-2 до 10 больных РПЖ.
Начинать гормональную терапию можно с двусторонней орхиэктомии, уменьшающей поступление андрогенов в кровь на 1/3. Назначение женских половых гормонов изменяет соотношение женских и мужских половых гормонов в сторону эстрогенов. Для лечения больных в основном применяются 2 гормональных препарата и их производные: синэстрол и диэтилстильбэстрол. Лечение гормонами целесообразно начинать после установления гистологического диагноза при исследовании биоптата, когда у больного высоко- или хотя бы малодифференцированная опухоль. При недифференцированных раках, где имеется первичная резистентность, назначать женские половые гормоны не следует.
В первые 2 нед синэстрол вводится по 80 мг/сут (4 мл 2% раствора), затем доза снижается до 40 мг (2 мл 2% раствора) и остается такой до 2 мес. В связи с наступающей феминизацией (изменение голоса, набухание молочных желез, снижение либидо) перед гормональной терапией проводится рентгеновское облучение молочных желез в дозе от 3 до 16 Дж/кг (от 300 до 1600 рад) на каждую из них.
Продолжать лечение можно введением фосфорных эфиров диэтилстильбэстрола, в том числе и отечественным фосфэстролом.
Методика его введения заключается в следующем. В первые 2 дня проводят пробные внутривенные инъекции половинных доз препарата по 250 мг (5 мл 5% раствора). В последующем в течение первых 2 нед вводят 500 мг фосфэстрола ежедневно, 3-4 нед - по 500 мг 2 раза в неделю, в последующем - 1 раз в неделю и так до 2 мес. Е. Б. Маринбах (1975) назначают фосфэстрол в суточной дозе до 750-1000 мг ежедневно на протяжении 3-5 нед. Аналогами фосфэстрола являются хонван, стильбэстрол, цитонал.
Воздействие эстрогенов на РПЖ рассматривается двояко. А. Б. Топчан (1966), Huggins (1941) отмечали непосредственное цитотоксическое их воздействие на раковые клетки в предстательной железе. И. Н. Шапиро, В. И. Рождественский (1955) и др. показали, что эстрогены вызывают фиброз межуточной ткани и вторичную дистрофию и атрофию межуточной ткани органа. Она выражается в жировом перерождении клеток, в процессах ороговения. В окружности раковых клеток возникают лимфоидные инфильтраты. По сути, это - процесс обратного развития рака. Он наблюдается даже в метастазах. При введении фосфорных эфиров диэтилстильбэстрола (фосфэстрол и др.) отмечается тропизм к эпителию ацинусов предстательной железы, содержащих большое количество фосфора. Особенно его много в опухолевых клетках при РПЖ. Эстрогенное действие оказывает и этинил эстрадиола в комбинации с полиэстрадиолфосфатом и эстрамуцинфосфатом [Daehlin L. et al., 1986].
Другая группа препаратов воздействует на надпочечники, снижая инкрецию половых гормонов. К ним относится хлортрианизен, или препарат ТАСЕ, который назначают в первые 1-2 нед по 60-70 мг/сут, в последующем по 10-15 мг/сут. Длительность курса лечения хлортрианизеном - 1 ½- 2 мес. После проведения основного курса лечения синэстролом и фосфэстролом (их можно повторять с интервалом в 2-3 нед) целесообразно назначение пролонгированных препаратов: эстрадола по 40 или 80 мг внутримышечно один раз в 2-4 нед, Progynon Depot и Progunon Retard по 1 мл, содержащему 100 мг эстрогенов. Для поддерживающего лечения назначается микрофоллин по 50 мг 3-4 раза в день в таблетках.
При устойчивости к эстрогенам назначают и эстрамуцина фосфат, или эстрацит. Лечение этим препаратом начинают с дозы 150 мг/сут, постепенно доводя ее до 560 мг/сут ежедневно или через день. Назначают его по 300 мг/сут в течение 12-40 дней до 1,8-10,8 г на курс. Е. Hoogendijk, Н. de Voogt (1986) применяют антиандрогены в комбинации с пролактиновыми препаратами. Новым сильнодействующим антиандрогеном является флютамид (флюцин), назначаемый по 600 мг/сут.
Для воздействия на систему "гипоталамус - аденогипофиз" применяется гормональный препарат гестаген, являющийся одним из дериватов прогестерона, назначаемый по 100-500 мг/сут. При устойчивости к эстрогенам назначают эстрамуцина фосфат (эстрацит), лечение которым начинают с дозы 150 мг/сут, постепенно доводя ее до 560 мг/сут ежедневно или через день. Назначается и эстрамуцин - по 300 мг в течение 12-20 дней курсом от 1,8 до 10,8 г или по 70 мг/сут.
У больных раком III-IV стадии с метастазами в кости и другие органы М. Yones и G. Williams (1980) добились увеличения продолжительности жизни больных лечением метотрексатом по 100 мг, 5-фторурацилом по 500 мг, циклофосфанамидом по 500 мг внутривенно 1 раз в неделю или 2 нед вместе или раздельно. При раке IV стадии применяют также и другие препараты, не закупаемые нашей страной: мелфален, гидроксимочевине, преднимусцин, ципротерона ацетат. Лечение ими носит паллиативный характер. F. Kazama и соавт. (1986) получили улучшение при назначении винкристина с тиофосфамидом и пепломицином.
При метастазах в кости с выраженными болями эстрогены сочетают с введением 100 Ед Коллипа паратиреоидина, обладающего тропизмом к кальцию в костях. Возможно сочетание с лучевой терапией 32Р.
Лечение эстрогенами приводит к сердечно-сосудистым осложнениям, которые в 60-70% случаев являются причиной гибели гормонально леченных больных. Объясняется это увеличением жировых фракций сыворотки крови, что ведет к тромбоэмболическим осложнениям и задержке жидкости в организме, приводящий к увеличению объема циркулирующей крови. В связи с этим назначается фуросемид по 40 мг 2 раза в неделю. У больных, длительно леченных эстрогенами в сочетании с кастрацией, наступает истощение коры надпочечников, поэтому им целесообразно назначать преднизолон по 2,5-5 мг 1-2 раза в день.
Хирургическое лечение РПЖ включает оперативные (радикальные, корригирующие и паллиативные) и инструментальные операции. С позиций абластики, наиболее целесообразна радикальная простатэктомия, заключающаяся в удалении предстательной железы и ее капсулы, семенных пузырьков и шейки мочевого пузыря. Операция предложена в начале века: промежностным доступом Young в 1906 г., позадилобковым - Van Stockum в 1909 г.; распространение начинает получать только в последние 10-15 лет в ряде клиник и центров. Ее проведению препятствовали относительные успехи гормональной терапии, особенно в сочетании с двусторонней орхиэктомией, а также осложнения, возникающие после этой тяжелой и травматической операции. Внедрению радикальной простатэктомии способствовали успехи анестезиологии, реаниматологии, трансфузиологии.
Радикальную простатэктомию лучше проводить в I-II стадии РПЖ [Smith Y. et al., 1984; Chopon D. de Kernion J., 1986, и др.]. В этой стадии выживаемость больных РПЖ в несколько раз выше, чем у гормонально леченных. Некоторые авторы предлагают при этом учитывать продолжительность оставшейся жизни и после 75 лет применять эстрогены и лучевую терапию. В выборе лечения следует ориентироваться и на результаты биопсии. При недифференцированном раке, не чувствительном к эстрогенам, показания к оперативному вмешательству расширяются. При решении вопроса о радикальной простатэктомии надо учитывать и возможные осложнения и даже оговаривать их с больными. Несмотря на некоторые оптимистические сообщения о минимальном числе осложнений простатэктомии, особенно по материалам конгресса Международного научного общества урологов в Амстердаме в 1974 г., в некоторых работах приводятся иные данные. R. Boxer и соавт. (1976), изучив 329 наблюдений радикальных простатэктомий, выполненных через позадилобковый и промежностный доступы за 25 лет, отметили значительное количество осложнений - соответственно 46 и 59%. В их числе временное и постоянное недержание мочи, кровотечение, раневая инфекция, тромбофлебиты, промежностные свищи, стриктуры шейки мочевого пузыря. В то же время получена высокая 5- и 10-летняя выживаемость: для I и II стадии рака (А, В) соответственно 82 и 63%, а для III стадии (С) - 67 и 29%.
Результаты радикального лечения, а они обусловливают и показания к этой операции, связывают с высокой хирургической абластичностью, с объемом вмешательства. При этом производится, в сущности, цистопростатэктомия [Walsh R. et al., 1984; Rampol M. et al., 1984, и др.] или двусторонняя тазовая лимфаденомэктомия с радикальной позадилобковой простатэктомией [Zincke Н. et al., 1984].
Методом выбора при радикальном лечении является позадилобковая простатэктомия, которая производится поперечным разрезом над лобком, по доступу не отличается от аденомэктомии по Лидскому.
Переднюю стенку мочевого пузыря вскрывают поперечным разрезом на 1,5-2 см выше предстательной железы. В устья мочеточников для контроля можно ввести мочеточниковые катетеры. Дистальную часть шейки мочевого пузыря пересекают. Предстательную железу с опухолью в капсуле и семенными пузырьками после перевязки семявыводящих протоков удаляют. Накладывают анастомоз между мочеиспускательным каналом и шейкой мочевого пузыря на дренажной трубке. При этом выкраивают лоскут из передней стенки мочевого пузыря. Производят эпицистостомию. Дренируют таз, предпузырное пространство. Накладывают швы на операционную рану.
Чаще простатэктомию производят в сочетании с удалением регионарных подвздошных и паховых узлов, что возможно только при позадилобковом доступе. Собственно с этого и со срочной биопсии лимфоузлов и начинается операция. При раке III стадии метастазы в регионарные лимфоузлы наблюдаются у 50% больных, а при лимфографии они выявляются только в половине случаев. Это свидетельствует в пользу позадилобкового доступа, так как при промежностном подходе лимфаденомэктомия невозможна. К тому же после промежностных операций несколько больше осложнений.
Производятся операции, корригирующие гормональный баланс. К ним относится двусторонняя орхиэктомия, заключающая в рассечении оболочек яичек и в выскабливании их паренхимы. Можно производить и типичную кастрацию, тогда как по косметическим и психологическим соображениям целесообразно провести протезирование пластмассовыми шариками. Двусторонняя орхиэктомия уменьшает поступление половых гормонов в кровь на 1 /3.
Для уменьшения потока половых гормонов из надпочечников прежде предлагалась двусторонняя адреналэктомия, что, естественно, приводит к надпочечниковой недостаточности и к необходимости пожизненной ее коррекции. Более оригинальное решение - увеличить разрушение или инактивацию половых гормонов в печени. Для этого чтобы поправить поток половых гормонов по воротной вене к печени, предлагают операции создания венозных анастомозов между левой надпочечниковой веной и селезеночной или со средней толстокишечной веной. Затем производят кастрацию и правостороннюю адреналэктомию. К. Eton и соавт. (1975) оперировали таким образом 25 больных с благоприятными результатами.
Оперативной коррекции можно достигнуть и гипофизэктомией - попыткой повлиять на патогенез заболевания и снять острые боли в костях при метастазах. Вместо оперативного лечения проводится и облучение гипофиза.
Y. Fergusson, W. Hendry (1971) провели местное облучение гипофиза 100 больным РПЖ. Под наркозом путем пункции основной кости в ямку гипофиза вводилось 222-444 МБк (6-12 мКи) 90Y. Авторы отметили уменьшение болей у большинства больных, быстрое снижение уровня тестостерона в крови. Из осложнений отмечены возникновение несахарного диабета у 22 больных, повреждение спинномозговых нервов - у 6, ликворея - у 25, гемиплегия - у 3, менингеальные явления - у 4; 4 больных умерли от менингита.
При РПЖ возникает необходимость и в паллиативных операциях, к которым относятся эпицистостомия, пиело- или нефростомия.
Исходы лечения РПЖ несколько неодинаковы, но в общем неоднородны. Если сравнить их с результатами консервативной терапии злокачественных новообразований иной локализации, то продолжительность жизни больных РПЖ, леченных гормональными препаратами, довольно высокая.
У больных РПЖ с наступившей задержкой мочи и наложенным мочепузырным свищом могут возникнуть показания к ТУР. Как правило, это тяжелые больные с РПЖ III-IV стадии. Для некоторых из них с более локализованным раком ТУР оказывается сравнительно радикальным вмешательством. У больных с распространенным раковым процессом спустя 1-2 года наступает рецидив или, точнее, продолжается рост опухоли. На результаты положительно влияет курс лечения фосфорными эфирами диэтилстильбэстрола (фосфэстрол, хонван). Несмотря на отдельные указания в литературе на возможность диссеминации опухоли во время ТУР [Levine Е. et al., 1986] при обструктивном опухолевом процессе с целью ликвидации мочепузырного свища, это оперативное вмешательство целесообразно, особенно в сочетании с гормональной и химической терапией.
К паллиативному хирургическому лечению РПЖ относится и криодеструкция. Некоторые авторы [Braun Н., Thiel К., 1973; Schlegel W. el al., 1976, и др.] получили тяжелые осложнения (мочевые и ректальные свищи, недержание мочи и др.), что объясняется некоторой неуправляемостью этой операцией. Создание низкой температуры (до -160 °С на криозонде и до -140... - 150°С в предстательной железе) может привести к замораживанию стенки мочевого пузыря и окружающих тканей. Мы также наблюдали серьезные осложнения, и метод стал применяться только при АПЖ и противопоказаниях к оперативному лечению. Однако в последние годы исследованиями установлена иммунная реакция на антиген замороженной опухолевой ткани предстательной железы, что усиливает резистентность больных раком [Ablin R. et al., 1979]. При этом обнаруживается содержание всех иммуноглобулинов. Реакция антиген-антитело с участием IgM является специфической против клеток опухоли. Несмотря на паллиативность, криодеструкция дает некоторый клинический эффект, наблюдается регресс метастазов опухоли предстательной железы [Sesia G. et al., 1982].
Значительный опыт проведения криодеструкции с 1972 г. у больных АПЖ при наличии противопоказаний к операции (314 наблюдений) позволяет нам рекомендовать ее применение у небольшого числа больных и при РПЖ. Операция проводится при наличии мочепузырного свища, т. е. открытым методом, при пальцевом контроле. Применение экспозиции "замораживания" с температурой на криозонде -160 °С 4 мин, с последующим размораживанием и повторением экспозиции снова 4-5 мин, дает возможность локализовать криовоздействие на патологические ткани без уменьшения силы его воздействия.
Лучевое лечение при РПЖ в последнее время применяется, тогда как длительное время было принято считать, что этот вид опухоли является рентгенорезистентным. В основном оно проводится у больных в III-IV (С, D) стадии заболевания. Применяется высоковольтное прицельное облучение, причем отдельные авторы [Schmidt-Hermes H.-J., Kopper J., 1971] пользовались высокими дозами - до 70-100 Дж/кг. В настоящее время за рубежом пользуются в основном комбинированным оперативно-лучевым методом под общим обезболиванием. Срединным разрезом над лобком обнажают и удаляют регионарные подвздошные лимфоузлы с обеих сторон и производят интерстициальную имплантацию 1251 в предстательную железу. Отмечается некоторая несовместимость эстрогено- и лучевой терапии.
Результаты гормональной терапии для такого злокачественного новообразования, каким является РПЖ, все же терпимые, по данным Е. Б. Маринбаха (1975), можно желать лучшего. Его больные жили 5 лет и более только в 22,3% наблюдений. По нашим данным, свыше 5 лет живут 41,7% больных при относительно раннем выявлении опухоли, во всяком случае до появления острой задержки мочи.
Исходы радикальных операций при РПЖ, по данным ранее приведенных авторов, превышают 80-90% 5-летней выживаемости, но при I-II стадии заболевания, выявить которую практически можно при диспансерном обследовании. Значительное число осложнений в виде неудерживания мочи уменьшило в последние годы число урологов, производящих радикальную простатэктомию.
Подход к оценке трудоспособности больных РПЖ индивидуальный. В целом больные нетрудоспособны. При отсутствии метастазов и в деонтологических целях, если позволяют условия труда и быта, можно по индивидуальной договоренности с родственниками больного и с экспертными врачебными органами не предоставлять ему I группу инвалидности и назначать только III группу, реже II. Тяжелобольным с постоянными болями за счет метастазов, что требует систематического введения наркотических средств и наблюдения врача, предоставляется I группа инвалидности.
Саркома предстательной железы
Заболевание встречается весьма редко. Поданным Е. Б. Маринбаха (1980), оно составляет 0,1-0,5%, по М. Н Жуковой (1959) - 1-3% злокачественных новообразований предстательной железы. В основном это опухоль детского и юношеского возраста, а также молодых мужчин. Изредка она встречается в пожилом старческом возрасте.
Этиология опухоли эмбриональная; она происходит из остатков ducti рагаmesonephrici. Морфологическая структура ее различная. Как все саркомы, она происходит из соединительной ткани. Саркома предстательной железы может быть веретеноклеточной, кругло- клеточной или смешанной. По гистологическому строению это может быть рабдомио-, миксо-, адено-, ангио-, лим-фосаркома и др.
Опухоль захватывает всю ткань предстательной железы, быстро растет, достигая больших размеров, сравнительно долго не вызывая обструкции мочевого пузыря. Это объясняется ее ростом в сторону мочевого пузыря и промежности. Поэтому при саркоме предстательной железы могут наступить не только задержка мочи или другие расстройства мочеиспускания, но и анурия при прорастании нижних отделов мочеточника, а также кишечная непроходимость при распространении опухоли в стенку прямой или сигмовидной кишки. Отмечаются слабость, снижение аппетита, похудание.
Описанные симптомы при наличии резко увеличенной предстательной железы могут навести на мысль об этом заболевании. У таких больных опухолевидное образование нередко пальпируется над лобком или выстоит в промежности.
При ректальном пальпаторном исследовании предстательной железы определяется опухоль значительных или больших размеров, реже плотноэластической консистенции, почти безболезненная. На внутривенных урограммах при обструкции нижних отделов мочеточников отмечаются снижение функции почек, уретеропиелоэктазия. На нисходящей цистограмме видна приподнятость мочевого пузыря, более выраженная, чем при РПЖ.
Дифференциальная диагностика в основном проводится с АПЖ. Решающим является пункционная биопсия. Если консистенция опухоли мякгоэластическая, а пальпация болезненна, то для дифференцирования от абсцесса предстательной железы проводится УЗИ.
Саркома предстательной железы метастазирует в кости таза и позвоночника, в легкие.
Метастазы в кости имеют остеокластический характер, тогда как при раке они чаще остеобластические.
Хирургическое лечение. При установлении с помощью пункционной биопсии гистологического диагноза показана радикальная расширенная простатэктомия с резекцией шейки мочевого пузыря с двусторонней тазовой лимфаденэктомией и иссечением жировой клетчатки таза.
Однако чаще всего хирургическое лечение носит паллиативный характер. При острой и хронической задержке мочи накладывают эпицистостому, при прорастании нижних отделов мочеточников производят пиело- или нефростомию. Радикальные операции производят в детском и молодом возрасте. При этом удаляют предстательную железу с семенными пузырьками и мочевой пузырь, производят пересадку мочеточников в прямую кишку.
Если опухоль проросла кишечник, то экстирпируют и прямую кишку с наложением колостомы; мочеточники пересаживают под кожу.
Высокая травматичность радикальной операции по поводу саркомы предстательной железы ограничивает возможности ее применения. Проводится высоковольтная лучевая терапия. Назначается сарколизин по 0,2 г в 300 мл 0,9% стерильного раствора натрия хлорида внутривенно капельно 1 раз в неделю, по 1 мл 1% раствора подкожно 1 раз в день или по 0,03 г (1 таблетка) внутрь 2-3 раза в день. Препарат противопоказан при сердечной, печеночной и почечной недостаточности.
Опухоли семенных пузырьков
Заболевание встречается исключительно редко. В литературе описаны всего лишь десятки наблюдений первичных опухолей семенного пузырька, вторичные наблюдаются несколько чаще.
Патологоанатомическая структура их различна. Они могут быть доброкачественными (фиброма, фибролипома, фиброаденома, ангиоэндотелиома, липома и др.) и злокачественными (в основном рак). У молодых мужчин изредка обнаруживаются саркомы семенного пузырька. Метастазирование происходит гематогенным и лимфогенным путями в легкие, плевру, брюшину.
Основным симптомом является боль, локализованная в промежности и глубоко в тазу, односторонняя, так как поражается чаще один пузырек. С увеличением размеров опухоли и прорастанием в окружающие ткани и соседние органы (в мочевой пузырь и прямую или сигмовидную кишку) боли усиливаются. Появляются расстройства мочеиспускания и дефекации.
При ректальном пальпаторном исследовании семенной пузырек при доброкачественных новообразованиях умеренно увеличен, сохраняет округлую и веретенообразную форму, плотной консистенции. Для злокачественных опухолей характерны большие размеры, бугристость, плотная консистенция, малая подвижность.
Саркомы отличаются мягкоэластической консистенцией.
При диагностике применяется трансректальная эхография, или УЗИ. Однако ввиду глубокого расположения органа и это исследование требует проведения и других методов. Прежде всего это пункционная, лучше трансректальная биопсия опухоли семенного пузырька. Для уточнения диагноза и степени возможного прорастания производится везикулография. Дифференцировать на основании этих исследований приходится от рака или саркомы предстательной железы, от туберкулеза семенного пузырька или камней его, с неспецифическим везикулитом.
Лечение в основном оперативное. Если оно своевременное, то может быть эффективным. При сравнительно небольших размерах опухоли преимущественный доступ - прямокишечноседалищный, при больших размерах - зависит от конкретных особенностей.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'